题目内容
【题目】阅读、分析下列两个材料:
材料一、如图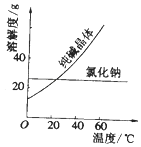
材料二
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 溶解性 |
乙二醇( C2H6O2) | ﹣11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
回答下列问题:
(1)要从氯化钠和纯碱的固体混合物中分离得到纯净的氯化钠,应先将固体溶解,再经过、洗涤、干燥等操作.
(2)将乙二醇和丙三醇相互分离的最佳方法是 , 写出该方法在操作上的注意事项(写出一项) .
【答案】
(1)蒸发结晶趁热过滤
(2)蒸馏法,蒸馏烧瓶中应加入沸石
【解析】解:(1)NaCl溶解度随温度变化较小,可在较高温度下除杂,可先将固体溶解,再经过蒸发结晶 趁热过滤、洗涤、干燥等操作;
(2)二者沸点不同,可蒸馏分离,蒸馏时应注意防止液体暴沸,可在蒸馏烧瓶中应加入沸石;
所以答案是:(1)蒸发结晶 趁热过滤;(2)蒸馏法; 蒸馏烧瓶中应加入沸石.

【题目】二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业. 
(1)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=a kJmol﹣1CO(g)+H2O (g)═CO2(g)+H2 (g)△H2=b kJmol﹣1
2CO(g)+O2(g)═2CO2(g)△H3=c kJmol﹣1
反应CO2(g)+CH4(g)═2CO(g)+2H2(g) 的△H=kJmol﹣1 .
(2)利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2═CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示. ①a点所代表的状态(填“是”或“不是”)平衡状态.
②c点CO2的转化率高于b点,原因是 .
(3)在实际生产中发现,随着甲醇的生成,还伴随有少量CO副产物出现:CO2+H2CO+H2O△H>0,且CO2的转化率、甲醇的产率和CO含量除受浓度、度、压强等因素影响外,还受催化剂CuO的质量分数、气体混合物在反应锅炉内的流动速率影响(用空间流率表示).通过实验分别得到如下数据图2、①由图2得,最佳空间流率为h﹣1; ②在其他条件不变的前提下调整催化剂配比,并记录到达平衡所需的时间,得到如下表数据,
催化剂组分质量分数(%) | CuO | 0 | 25 | 50 | 75 | 100 |
ZnO | 100 | 75 | 50 | 25 | 0 | |
到达平衡所需时间(h) | 2.5 | 7.4 | 8.1 | 12 | 无催化活性 | |
试说明不选择单组份ZnO原因是 .
(4)用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图4所示: ①该进行的反应的△S0(填:“>”或“<”)
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图4所示: ①该进行的反应的△S0(填:“>”或“<”)
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP= .
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是(列举2项).
