题目内容
【题目】
(1)有下列四组物质①水、酒精、煤、石油 ②CaO、SO3、SO2、P2O5 ③HNO3、H2SO4、HCl、NaCl ④KClO3、KCl、KMnO4、HgO各组中均有一种物质所属类别与其他物质不同,这四种物质分别是:①;②;③;④。
(2)在标准状况下,1 L水溶解了一定体积的NH3 , 所得溶液的密度为ρ g·cm-3 , 物质的量浓度为a mol·L-1 , 则所溶解的NH3的体积为L。
(3)3.01×1023个OH-的物质的量为mol,质量为g,含有电子的物质的量为mol,含有质子的数目为 , 这些OH-与mol NH3的质量相同.与克Na+含有的离子数相同。
【答案】
(1)煤或水,CaO,NaCl,HgO
(2)![]()
(3)0.5,8.5,5,4.5NA,0.5,11.5
【解析】解:(1)①水、酒精、石油均为液体,而煤为固体,或酒精、煤、石油的主要成分为有机物,而水为无机物,故选水,
所以答案是:煤或水;
②CaO为碱性氧化物,SO3、SO2、P2O5均为酸性氧化物,
所以答案是:CaO;
③HNO3、H2SO4、HCl均为酸,而NaCl属于盐,
所以答案是:NaCl;
④KClO3、KCl、KMnO4均为盐,而HgO属于氧化物,
所以答案是:HgO;
(2)假设氨气的体积为xL,则NH3的物质的量为 ![]() =
= ![]() mol,溶于水配成1L的溶液,所得溶液的质量为
mol,溶于水配成1L的溶液,所得溶液的质量为 ![]() mol×17g/mol+1000g=(
mol×17g/mol+1000g=( ![]() +1000)g,溶液的体积为(
+1000)g,溶液的体积为( ![]() +1000)g÷ρ g·cm-3 =
+1000)g÷ρ g·cm-3 = ![]() cm3=
cm3= ![]() L,物质的量浓度为a mol·L-1=
L,物质的量浓度为a mol·L-1= 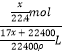 ,解得x=
,解得x= ![]() L,
L,
所以答案是: ![]() L;
L;
(3)OH-的物质的量为 ![]() =0.5mol,其质量为0.5mol×17g/mol=8.5g,含有电子物质的量为0.5mol×1=5mol,OH-、NH3的摩尔质量相等,二者质量相等,则二者物质的量相等,即这些OH-与0.5mol NH3的质量相同,含有质子4.5mol,数目为4.5NA,0.5molNa+的质量为0.5mol×23g/mol=11.5g,
=0.5mol,其质量为0.5mol×17g/mol=8.5g,含有电子物质的量为0.5mol×1=5mol,OH-、NH3的摩尔质量相等,二者质量相等,则二者物质的量相等,即这些OH-与0.5mol NH3的质量相同,含有质子4.5mol,数目为4.5NA,0.5molNa+的质量为0.5mol×23g/mol=11.5g,
所以答案是:0.5;8.5;5;0.5;4.5NA,11.5。

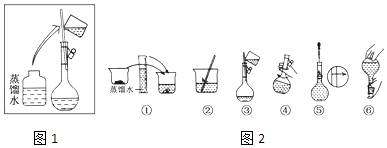
【题目】阅读、分析下列两个材料:
材料一、如图
材料二
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 溶解性 |
乙二醇( C2H6O2) | ﹣11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
回答下列问题:
(1)要从氯化钠和纯碱的固体混合物中分离得到纯净的氯化钠,应先将固体溶解,再经过、洗涤、干燥等操作.
(2)将乙二醇和丙三醇相互分离的最佳方法是 , 写出该方法在操作上的注意事项(写出一项) .