题目内容
【题目】下列有关溶液中微粒的物质的量浓度关系不正确的是
A.![]() 溶液与
溶液与![]() 溶液等体积混合:
溶液等体积混合:![]()
B.某温度下,![]() ,
,![]() ;将
;将![]()
![]() 的
的![]() 溶液滴入
溶液滴入![]()
![]() 的KCl和
的KCl和![]()
![]() 的
的![]() 溶液,则先产生
溶液,则先产生![]() 沉淀
沉淀
C.![]()
![]() 溶液与
溶液与![]()
![]() 溶液等体积混合:
溶液等体积混合:![]()
D.在![]()
![]() 氨水中滴加
氨水中滴加![]()
![]() 盐酸,刚好完全中和时
盐酸,刚好完全中和时![]() ,则由水电离产生的
,则由水电离产生的![]()
【答案】B
【解析】
A、因混合后溶液中含等量的NaCl、HAc,醋酸部分电离,溶液呈酸性,所以离子浓度大小为![]() ;
;
B、根据![]() 、
、![]() ,计算
,计算![]() 、
、![]() 开始沉淀时
开始沉淀时![]() 各是多少;
各是多少;
C、![]()
![]() 溶液与
溶液与![]()
![]() 溶液等体积混合中,钠与碳的所有微粒的物质的量之比为3:2,则根据物料守恒:
溶液等体积混合中,钠与碳的所有微粒的物质的量之比为3:2,则根据物料守恒:![]() ;
;
D、刚好完全中和时,氢离子与氢氧根离子浓度相等,![]() 的溶液中
的溶液中![]() 。
。
A、因混合后溶液中含等量的NaCl、HAc,醋酸部分电离,溶液呈酸性,所以离子浓度大小为![]() ,故A不符合题意;
,故A不符合题意;
B、根据![]() 、
、![]() ,则当
,则当![]() 开始沉淀时
开始沉淀时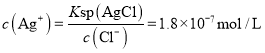 ,当
,当![]() 开始沉淀时
开始沉淀时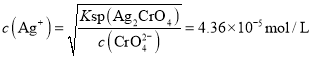 ,故先产生AgCl沉淀,故B符合题意;
,故先产生AgCl沉淀,故B符合题意;
C、![]()
![]() 溶液与
溶液与![]()
![]() 溶液等体积混合中,钠与碳的所有微粒的物质的量之比为3:2,则根据物料守恒:
溶液等体积混合中,钠与碳的所有微粒的物质的量之比为3:2,则根据物料守恒: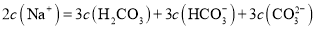 ,故C不符合题意
,故C不符合题意
D、在![]() 氨水中滴加
氨水中滴加![]() 盐酸,刚好完全中和时
盐酸,刚好完全中和时![]() ,则溶液中
,则溶液中![]() ,故D不符合题意;
,故D不符合题意;
故选B。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】在一定温度下,1L密闭容器中通入H2和I2各0.016 mol,发生如下反应:H2(g)+I2(g)2HI(g),一段时间后达到平衡,测得数据如下:
t/min | 2 | 4 | 7 | 9 |
n(I2)/mol | 0.012 | 0.011 | 0.01 | 0.01 |
请回答:(1)2min内,v(H2) =______mol/(L·min)。
(2)下列能证明该反应已经达到平衡的是______(填字母)。
a.V正(H2)=V逆(HI)
b.混合气体的颜色不再发生变化
c.混合气体中各组分的物质的量不再发生变化
d.混合气体的密度不再变化
(3)该温度下反应的化学平衡常数数值是______。
(4)H2的平衡转化率是______。
(5)温度降低时,该反应的平衡常数变大,则正反应是______(填“放热”或“吸热”)反应。
(6)一定可以提高平衡体系中HI百分含量的措施是____(填字母)。
a.降低温度 b.增大H2浓度 c.加入催化剂 d.降低压强