题目内容
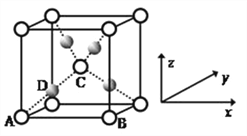
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
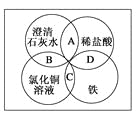
A. OH-+HCl===H2O+Cl-
B. Ca(OH)2+Cu2+===Ca2++Cu(OH)2
C. Fe+Cu2+===Cu+Fe2+
D. Fe+2H+===Fe3++H2↑
【答案】C
【解析】A中盐酸是强酸,在溶液中应拆成离子形式,正确的离子方程式为H++OH-===H2O;B中澄清石灰水中Ca(OH)2应拆成离子形式,正确的离子方程式为2OH-+Cu2+===Cu(OH)2↓;C中铁能置换出氯化铜中的铜,原子守恒,电荷也守恒,正确;D中铁与稀盐酸反应生成
Fe2+,正确的离子方程式为Fe+2H+===Fe2++H2↑。故正确答案为C。

【题目】汽车尾气主要含有CO2 、CO、SO2、NOx 等物质,尾气中CO、氢氧化物(NOx) 严重影响人们的生活和健康,化学工作者对氮氧化物的处理做了广泛而深入的研究。
(1)利用甲烷还原NOx
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mo l;
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+H2O(g) △H2=-1160kJ/mo l,
甲烷直接将NO2还原为N2的热化学方程式为________________________________。
(2)将不同量的CO(g)积H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 4 |
3 | 900 | a | b | c | d | t |
①实验1中以v(CO2) 表示的反应速率为/span>_________(保留两位有效数字,下同)。
②该反应为________(填“吸热”或“放热”) 反应,实验2条件下的平衡常数K=________。
③若达平衡状态时,实验2 与实验3中各物质的质量分数分别相等,且t<4min,则a、b应满足的关系是_________________________(用含a、b的数学式表示)。
(3)CO分析仪的传感器可测定汽车尾气是否符合排放标准。该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3) 和氧化锆(ZrO2) 晶体,能传导O2-,则负极的电极反应式为____________。
(4)SO2可用钙基固硫反应除去,反应生成的CaSO4是一种微溶物质,其Ksp=9.0×10-6。若将浓度为2×10-3mol/L的Na2SO4溶液与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为_____________。