题目内容
【题目】三氧化硫是一种强氧化剂,熔点为16.8℃,沸点为44.8℃,在50℃可升华,某合作学习小组的同学设计实验制备少量SO3.回答下列问题:
(1)甲组同学用图(a)所示装置制备少量SO3
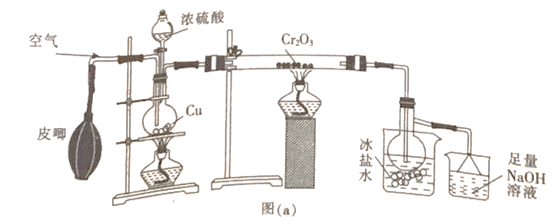
①盛有冰盐水烧杯的作用是_____________________。
②烧瓶中发生反应的化学方程式为_______________;烧杯中最后所含的盐为______(填化学式)。
(2)乙组同学用图(b)装置制备少量SO3,反应原理为2NO2+4SO2=4SO3+N2
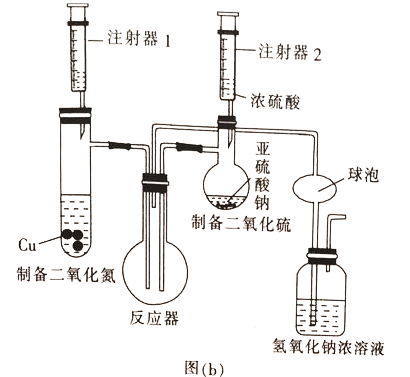
①装入药品后检验该装置气密性的方法是________________________。
②球泡的作用是___________,实验过程中反应器中观察到的现象是_______________。
【答案】将SO2蒸气冷却为固体Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2ONa2SO3(或Na2SO3和Na2SO4)将反应器微热,广口瓶导管口有气泡逸出,停止加热,液体上升形成一段液柱防止倒吸红棕色气体逐渐消失并产生白雾
CuSO4+SO2↑+2H2ONa2SO3(或Na2SO3和Na2SO4)将反应器微热,广口瓶导管口有气泡逸出,停止加热,液体上升形成一段液柱防止倒吸红棕色气体逐渐消失并产生白雾
【解析】
(1)①因为三氧化硫熔点为16.8℃,沸点为44.8℃,在50℃可升华,所以盛有冰盐水烧杯的作用是将SO2蒸气冷却为固体。
②烧瓶中发生的反应是浓硫酸和铜的反应,其化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;烧杯中的氢氧化钠作用是吸收没反应的二氧化硫气体,是SO2+2NaOH= Na2SO3+H2O ,Na2SO3不稳定易被氧化。 所以烧杯中最后所含的盐为Na2SO3或者Na2SO3和Na2SO4)。
CuSO4+SO2↑+2H2O;烧杯中的氢氧化钠作用是吸收没反应的二氧化硫气体,是SO2+2NaOH= Na2SO3+H2O ,Na2SO3不稳定易被氧化。 所以烧杯中最后所含的盐为Na2SO3或者Na2SO3和Na2SO4)。
(2)①装入药品后检验该装置气密性的方法是:将反应器微热,广口瓶导管口有气泡逸出,停止加热,液体上升形成一段液柱。
②因为二氧化硫易和氢氧化钠反应,SO2+2NaOH= Na2SO3+H2O 所以球泡的作用是防止倒吸,实验过程中反应器中二氧化氮和二氧化硫反应2NO2+4SO2=4SO3+N2,三氧化硫在50℃可升华,所以观察到的现象是红棕色气体逐渐消失并产生白雾。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案【题目】镧系为元素周期表中第ⅢB族、原子序数为57~71的元素。
(1)镝(Dy)的基态原子电子排布式为[Xe]4f106s2,画出镝(Dy)原子外围电子排布图:___________。
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+ 的电子排布式为________________。
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3 价的元素是___________(填元素名称)。几种镧系元素的电离能(单位:kJ mol-1)
元素 | I1 | I2 | I3 | I4 |
Yb(镱) | 604 | 1217 | 4494 | 5014 |
Lu(镥) | 532 | 1390 | 4111 | 4987 |
La(镧) | 538 | 1067 | 1850 | 5419 |
Ce(铈) | 527 | 1047 | 1949 | 3547 |
(4)元素铕(Eu)可以形成配合物[Eu(NH3)2(H2O)2]Cl2。
①配合物的中心原子的配位数为_____,配体分子具有相同的___________(从给出选项中用序号表示)。
a.分子的立体构型 b.VSEPR构型 c.键角
d.孤电子对数 e.中心原子的价层电子对数
②写出氮的最简单气态氢化物水溶液中存在的氢键:__________________(任写一种)。
③元素Al 也有类似成键情况,气态氯化铝分子表示为(AlCl3)2,分子中Al 原子杂化方式为_____________,分子中所含化学键类型有______________(填字母)。
a.离子键 b.极性键 C.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中镨原子位于面心和顶点,则PrO2的晶胞中有________个氧原子;已知晶胞参数为a pm,密度为ρ g· cm-3,Mr(Pr O2) =173,则NA=_____________(用含a、ρ的代数式表示)。
【题目】如表为周期表中短周期的一部分,若X原子的最外层电子数是Y原子内层电子总数的![]() ,则下列说法不正确的是
,则下列说法不正确的是![]()
![]()
W |
|
|
|
| X | Y | Z |
A. Y的最高价氧化物的水化物的酸性比X的强 B. W、Z组成的某化合物是一种常见的溶剂
C. 原子半径大小比较:![]() D. W形成的氢化物种类很多
D. W形成的氢化物种类很多








