题目内容
【题目】按要求填空:
(1)将切开的小块钠投入到FeCl3溶液,现象是_________;反应的方程式为_____________。
(2)实验室常用还原性Fe粉与水蒸气反应的实验来研究Fe的还原性,则该反应的化学反应方程式为_____________________.
(3)分别将0.2mol的钠、镁、铝分别投入100ml 1mol·L-1的盐酸溶液中,三者产生的氢气在相同条件下的体积比为____________________。
(4)用双线桥标出电子转移的方向和数目: MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O________
MnCl2+Cl2↑+2H2O________
【答案】钠浮在水面上,熔化成小球,四处游动,发出嘶嘶响声,有红褐色沉淀生成 2Na+2H2O=2NaOH+H2↑,3NaOH+FeCl3=Fe(OH)3↓+3NaCl 3Fe+4H2O(g) ![]() Fe3O4+4H2 2:1:1
Fe3O4+4H2 2:1:1 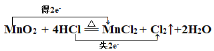
【解析】
(1) 将切开的小块钠投入到FeCl3溶液中,钠先与水剧烈地反应,生成的NaOH又与FeCl3反应生成Fe(OH)3红褐色沉淀,所以实验现象是钠浮在水面上,熔化成小球,四处游动,发出嘶嘶响声,有红褐色沉淀生成。其反应的化学方程式为2Na+2H2O=2NaOH+H2↑,3NaOH+FeCl3=Fe(OH)3↓+3NaCl。
(2)还原性铁粉能将水蒸气中氢元素置换生成H2,该反应的化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2(g)。
Fe3O4+4H2(g)。
(3) 100ml 1mol·L-1的盐酸溶液中HCl物质的量=0.1L×1mol/L=0.1mol,将钠投入到盐酸中钠先与HCl反应,过量的钠继续与水反应直至耗尽2Na+2HCl=2NaCl+H2↑,2Na+2H2O=2NaOH+H2↑,由计量关系知2Na~H2↑,所以0.2mol钠生成0.1molH2。由反应式Mg+2HCl=MgCl2+H2↑知0.2mol镁过量, 0.1molHCl完全反应生成0.05molH2。由反应式2Al+6HCl=2AlCl3+3H2↑知0.2mol铝过量,0.1molHCl完全反应生成0.05molH2。因为相同条件下气体的体积比等于其物质的量之比,钠、镁、铝分别与盐酸反应产生氢气的体积比=0.1mol:0.05mol:0.05mol=2:1:1。
(4)分析反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中元素化合价知:锰元素化合价由MnO2的+4价变化到MnCl2的+2价,化合价降低,每个锰原子得到2个电子;氯元素化合价由HCl的-1价变化到Cl2的0价,化合价升高,2个HCl失去2个电子。所以电子转移的方向和数目表示为:
MnCl2+Cl2↑+2H2O中元素化合价知:锰元素化合价由MnO2的+4价变化到MnCl2的+2价,化合价降低,每个锰原子得到2个电子;氯元素化合价由HCl的-1价变化到Cl2的0价,化合价升高,2个HCl失去2个电子。所以电子转移的方向和数目表示为: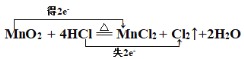 。
。

 特高级教师点拨系列答案
特高级教师点拨系列答案 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案