题目内容
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是
| A.Mg2+ + 2HCO3- + 2Ca2+ + 4OH-= Mg(OH)2↓+ 2CaCO3↓+ 2H2O |
| B.Cu2+ + H2S = CuS↓+ 2H+ |
| C.Zn2+ + S2- + 2H2O = Zn(OH)2↓+ H2S↑ |
| D.FeS + 2H+= Fe2+ + H2S↑ |
C
试题分析;由溶解度:Zn(OH)2>ZnS可知C选项应该生成的应该是溶解度更小的是ZnS而不是Zn(OH)2所以C选项是错误的

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
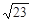 ×10-3mol·L-1
×10-3mol·L-1
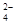 )一定等于3×10-3 mol·L-1
)一定等于3×10-3 mol·L-1

 CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。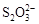

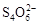 +2I―。相关物质的溶度积常数见下表:
+2I―。相关物质的溶度积常数见下表: Ca(OH)2(aq)
Ca(OH)2(aq)