题目内容
【题目】氮及其化合物是重要的化工原料
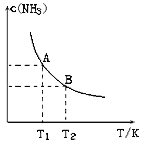
(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。当温度由T1变化到T2时,平衡常数关系K1 ______K2(填“>”、“<”或“=”),焓变△H______0(填“>”或“<”)。
(2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) ![]()
![]() 4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是_____(填字母代号)。
4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是_____(填字母代号)。
a.增大压强 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(3)已知:2NO2(g)![]() N2O4(g),N2O4为无色气体。
N2O4(g),N2O4为无色气体。
① 在上述条件下反应能够自发进行,则反应的ΔH________0(填写“>”、“<”或“=”)
② 一定温度下,在密闭容器中反应2NO2(g)![]() N2O4(g)达到平衡,达到平衡状态的标志 _______。
N2O4(g)达到平衡,达到平衡状态的标志 _______。
A.单位时间内生成n mol N2O4的同时生成2 nmolNO2
B.用NO2、N2O4的物质的量浓度变化表示的反应速率之比为2:1的状态
C.混合气体的颜色不再改变的状态
D.混合气体的密度不再改变的状态
E.混合气体的平均相对分子质量不再改变的状态
(4)17℃、1.01×105Pa,往10L密闭容器中充入NO2,达到平衡时,c(NO2)=0.2 mol·L-1,c(N2O4)=0.16 mol·L-1。则反应达到平衡时, NO2的转化率为__________;此温度下该反应的平衡常数K=________.
【答案】> < c < A C E 62% 或61.5% 4
【解析】
(1)由图可知,温度越高,平衡时NH3的浓度越小,说明升高温度平衡向逆反应进行,平衡常数减小,故平衡常数K1>K2,温度越高,K值越小,所以正反应是放热反应;
(2)4NH3(g)+5O2(g) ![]()
![]() 4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,
4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,
a.反应是气体体积增大的反应,增大压强,反应速率增大,平衡逆向移动;
b.反应是放热反应,适当升高温度,反应速率增大,平衡逆向进行;
c.增大O2的浓度,平衡正向进行,反应速率增大;
d.选择高效催化剂只能改变化学反应速率,但不改变化学平衡;
(3)①2NO2(g)![]() N2O4(g),N2O4为无色气体,在上述条件下,反应能够自发进行,说明ΔH-TΔS<0,反应的ΔS<0,则满足ΔH-TΔS<0,则ΔH<0;
N2O4(g),N2O4为无色气体,在上述条件下,反应能够自发进行,说明ΔH-TΔS<0,反应的ΔS<0,则满足ΔH-TΔS<0,则ΔH<0;
②一定温度下,在密闭容器中反应2NO2(g)![]() N2O4(g)达到平衡的标志是正逆反应速率相等;
N2O4(g)达到平衡的标志是正逆反应速率相等;
(4)根据三段式计算。
(1)由图可知,温度越高,平衡时NH3的浓度越小,说明升高温度平衡向逆反应进行,平衡常数减小,故平衡常数K1>K2,温度越高,K值越小,所以正反应是放热反应,故答案为:> ; <;
(2)4NH3(g)+5O2(g) ![]()
![]() 4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,
4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,
a.反应是气体体积增大的反应,增大压强,反应速率增大,平衡逆向移动,故a错误;
b.反应是放热反应,适当升高温度,反应速率增大,平衡逆向进行,故b错误;
c.增大O2的浓度,平衡正向进行,反应速率增大,故c正确;
d.选择高效催化剂只能改变化学反应速率,但不改变化学平衡,故d错误;
故答案为:c。
(3)①2NO2(g)![]() N2O4(g),N2O4为无色气体,在上述条件下,反应能够自发进行,说明ΔH-TΔS<0,反应的ΔS<0,则满足ΔH-TΔS<0,则ΔH<0,故答案为:<;
N2O4(g),N2O4为无色气体,在上述条件下,反应能够自发进行,说明ΔH-TΔS<0,反应的ΔS<0,则满足ΔH-TΔS<0,则ΔH<0,故答案为:<;
②一定温度下,在密闭容器中反应2NO2(g)![]() N2O4(g)达到平衡的标志是正逆反应速率相等;
N2O4(g)达到平衡的标志是正逆反应速率相等;
A.单位时间内生成n mol N2O4的同时生成2 nmolNO2,说明正逆反应速率相等;故A正确;
B.速率之比等于化学计量数之比,不能说明反应达到平衡状态,故B错误;
C.颜色不变,说明二氧化氮的浓度不变,反应达到平衡状态,故C正确;
D.密度等于气体质量除以体积,反应过程中密度始终不变,混合气体的密度不再改变的状态,不能说明反应达到平衡状态,故D错误;
E.反应是气体体积减少的反应,质量守恒,当混合气体的平均相对分子质量不再改变的状态,是气体物质的量不变,反应达到平衡状态,故E正确;
故答案为:ACE。
(4)17℃、1.01×105Pa,往10L密闭容器中充入NO2,达到平衡时,c(NO2)=0.2 mol·L-1,c(N2O4)=0.16 mol·L-1,
2NO2(g)![]() N2O4(g)
N2O4(g)
起始(mol·L-1)0.52 0
转化(mol·L-1)0.32 0.16
平衡(mol·L-1)0.2 0.16
NO2的转化率为(0.32 mol·L-1/0.52mol·L-1 )×100%≈62%,该反应的平衡常数为K= 0.16
/0.22=4,故答案为:62% 或61.5%; 4。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案