题目内容
【题目】实验室常下图装置进行铜跟浓硫酸反应等一系列实验。请回答下列问题
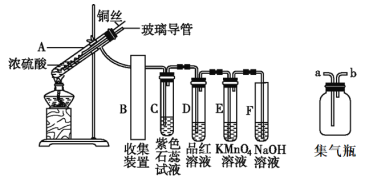
(1)装置B就是右上图的集气瓶,则装置A的导管应连接集气瓶的____(填“a”或“b”)进口;
(2)用装置A制备SO2的优点主要是_________________________。(任答一条即可);
(3)装置A中的反应方程式为______________________________________________;
(4)装置C中的现象是________________;反应结束后加热D中溶液,现象是___________;
(5)装置E中出现的现象可以说明SO2具有__________性;
(6)装置F中的反应的离子方程式为____________________________________________;
【答案】a 可以控制反应的发生与停止、可以防止倒吸 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 溶液变红 溶液恢复红色 还原性 SO2+2OH-=SO32-+H2O
CuSO4+SO2↑+2H2O 溶液变红 溶液恢复红色 还原性 SO2+2OH-=SO32-+H2O
【解析】
(1)根据二氧化硫的密度大于空气分析解答;
(2)依据装置特点解答;
(3)在加热的条件下铜与浓硫酸反应生成二氧化硫、硫酸铜和水;
(4)根据二氧化硫溶于水生成亚硫酸分析;根据二氧化硫的漂白特点分析;
(5)根据高锰酸钾溶液具有强氧化性解答;
(6)根据二氧化硫是酸性氧化物能与氢氧化钠溶液反应解答。
(1)由于二氧化硫的密度大于空气,因此可以用向上排空气法收集二氧化硫,则装置A的导管应连接集气瓶的a进口;
(2)由于装置中铜丝是可以抽出的,因此用装置A制备SO2的优点主要是可以控制反应的发生与停止、可以防止倒吸;
(3)在加热的条件下铜与浓硫酸反应生成二氧化硫、硫酸铜和水,根据原子守恒可知装置A中的反应的方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(4)二氧化硫溶于水生成亚硫酸,亚硫酸是二元酸,溶液显酸性,则装置C中紫色的石蕊试液变红;二氧化硫能使品红溶液褪色,但二氧化硫的漂白是不稳定的,因此反应结束后加热D中溶液,现象是溶液恢复红色;
(5)高锰酸钾溶液具有强氧化性,二氧化硫通入高锰酸钾溶液中溶液褪色,说明高锰酸钾被二氧化硫还原,因此装置E中出现的现象可以说明SO2具有还原性;
(6)二氧化硫是酸性氧化物,能与氢氧化钠溶液反应生成亚硫酸钠和水,则装置F中反应的离子方程式为SO2+2OH-=SO32-+H2O。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】对一定量气体体积的探究。
已知1 mol不同气体在不同条件下的体积:
化学式 | 条件 | 1 mol气体体积/L |
H2 | 0 ℃,101 kPa | 22.4 |
O2 | 0 ℃,101 kPa | 22.4 |
CO | 0 ℃,101 kPa | 22.4 |
H2 | 0 ℃,202 kPa | 11.2 |
CO2 | 0 ℃,202 kPa | 11.2 |
N2 | 273 ℃,202 kPa | 22.4 |
NH3 | 273 ℃,202 kPa | 22.4 |
(1)从上表分析得出的结论:
①1 mol任何气体,在标准状况下的体积都约为________。
②1 mol不同的气体,在不同的条件下,体积________(填“一定”“一定不”或“不一定”)相等。
(2)理论依据:相同条件下,1 mol任何气体的体积几乎相等,原因是:
①________________________________________________________________________,
②________________________________________________________________________。
(3)应用:在标准状况下,4 g O2的体积为多少升?(写出计算过程)___________________________________________________________________________