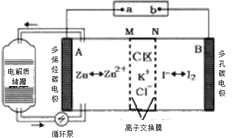
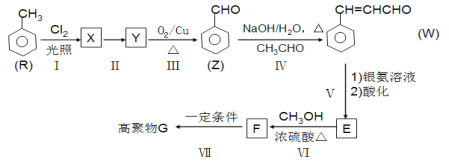
题目内容
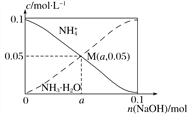
【题目】某浓度的氨水中存在下列平衡:NH3·H2O![]() NH4++OH-,若想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
NH4++OH-,若想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
A. 适当升高温度B. 加入NaCl固体C. 加入少量盐酸D. 通入NH3
【答案】C
【解析】
氨水存在电离平衡NH3H2ONH4++OH-,要想增大NH4+的浓度,而不增大OH-的浓度,则加入的物质必须含有铵根离子或含有能和氢氧根离子反应的离子,以此解答该题。
A.适当升高温度,促进物质的电离,电离平衡正向移动,c(NH4+)增大,c(OH-)增大,A错误;
B.加入NaCl固体,电离产生的Na+、Cl-对氨水的电离平衡不产生任何影响,B错误;
C.加入少量盐酸,盐酸电离产生的H+和氢氧根离子反应生成水,促进氨水电离,c(NH4+)增大,c(OH-)减小,C正确;
C.向氨水中通入氨气,c(NH4+)增大,c(OH-)增大,D错误;
故合理选项是C。

【题目】Ⅰ.能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
已知:C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+![]() O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH3=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH3=-283.0 kJ·mol-1
则煤气化主要反应C(s)+H2O(g)=CO(g)+H2(g)的ΔH=____________________。
Ⅱ.为了减少CO的排放,某环境研究小组以CO和H2为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
(1)如图所示能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母),其判断理由是____________。

(2)在一定温度下,向2.0 L固定容积的密闭容器中充入2 mol H2和1 mol CO,经过一段时间后,反应4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
时间/min | 0 | 20 | 40 | 80 | 100 |
n(H2)/mol | 2.0 | 1.4 | 0.85 | 0.4 | — |
n(CO)/mol | 1.0 | — | 0.425 | 0.2 | 0.2 |
n(CH3OCH3)/mol | 0 | 0.15 | — | — | 0.4 |
n(H2O)/mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
①0~20 min的平均反应速率v(CO)=__________________mol·L-1·min-1;
②达到平衡时,H2的转化率为__________________;
③在上述温度下,该反应的平衡常数K=______________________;
④能表明该反应达到平衡状态的是________(填序号);
A CO的转化率等于H2O的产率 B 混合气体的平均相对分子质量不变
C v(CO)与v(H2)的比值不变 D 混合气体的密度不变
⑤在上述温度下,向平衡后的2 L容器中再充入0.4 mol H2和0.4 mol CH3OCH3(g),则化学平衡________移动(填“向左”“向右”或“不”)。