题目内容
分析下表中的四个热化学方程式,判断氢气和丙烷的燃烧热分别是
| “嫦娥一号” 发射火箭燃料 | 液氢(H2) | ①2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1 ②2H2(l)+O2(l)=2H2O(g) △H=-482.6kJ·mol-1 |
| 北京奥运会“祥云” 火炬燃料 | 丙烷(C3H8) | ③C3H8(l)+5O2(g)=3CO2(g)+4H2O(g)△H=-2013.8kJ·mol-1 ④C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2221.5kJ·mol-1 |
C.285.8 kJ·mol-1,2013.8 kJ·mol-1 D.285.8 kJ·mol-1,2221.5 kJ·mol-1
D
解析试题分析:燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量。1mol氢气燃烧生成液态水时放出的热量是氢气的燃烧热,所以根据热化学方程式2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1可知,氢气的燃烧热为571.6kJ·mol-1÷2=285.8 kJ·mol-1;1mol丙烷完全燃烧生成CO2气体和液态水时放出的热量是丙烷的燃烧热,所以根据热化学方程式C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2221.5kJ·mol-1可知,丙烷的燃烧热为2221.5 kJ·mol-1,答案选D。
考点:考查燃烧热的有关判断和计算

在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+ O2(g)=CO2(g)+2H2O(l);ΔH="+725.8" kJ/mol O2(g)=CO2(g)+2H2O(l);ΔH="+725.8" kJ/mol |
| B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH=-1452 kJ/mol |
| C.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH=-725.8 kJ/mol |
| D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);ΔH="+1452" kJ/mol |
下列说法正确的是
| A.氢气是一种高效而没有污染的一级能源 |
| B.太阳能、氢能、风能、海洋能、地热能和生物质能等都是新能源 |
| C.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0 |
| D.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
镁粉与碘粉均匀混合,滴加几滴水,发生剧烈反应,并产生大量紫色蒸气。以下叙述错误的是
| A.H2O作催化剂 | B.紫色蒸气是I2 |
| C.该反应是放热反应 | D.反应后物质的总能量升高 |
强酸与强碱的稀溶液发生中和反应的热效应:
H+(aq)+ OH-(aq) → H2O (l) +57.3kJ
向1L0.5mol/L的NaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,则恰好完全反应时的热效应Q1、Q2、Q3的关系正确的是
| A.Q1 < Q2 < Q3 | B.Q1 > Q3 > Q2 | C.Q2 > Q1 > Q3 | D.Q1 < Q3 < Q2 |
已知在25℃时:
①2C(石墨)+O2(g)=2CO(g) △H1=-222kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H2=-484kJ/mol
③C(石墨)+O2(g)=CO2 △H3=-394kJ/mol
则25℃时,CO(g)+H2O(g)=CO2(g)+H2(g)的反应热△H4为:
| A.-82kJ/mol | B.-41kJ/mol | C.-312kJ/mol | D.+41kJ/mol |
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%。下列热化学方程式正确的是( )。
A.2SO3(g) 2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1 2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1 |
B.2SO2(g)+O2(g) SO3(g)ΔH=-98.3 kJ·mol-1 SO3(g)ΔH=-98.3 kJ·mol-1 |
C.SO2(g)+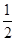 O2(g) O2(g) SO3(g)ΔH=+98.3 kJ·mol-1 SO3(g)ΔH=+98.3 kJ·mol-1 |
D.SO2(g)+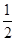 O2(g) O2(g) SO3(g)ΔH=-196.6 kJ·mol-1 SO3(g)ΔH=-196.6 kJ·mol-1 |
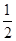 O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2
O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2