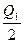题目内容
含NaOH 20.0g的稀溶液与足量稀盐酸反应,放出28.7 kJ的热量,表示该反应的热化学方程式正确的是
| A.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=" +28.7" kJ·mol-1 |
| B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H= _28.7 kJ·mol-1 |
| C.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H="+57.4" kJ·mol-1 |
| D.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H= _57.4 kJ·mol-1 |
D
20.0gNaOH是0.5mol,与足量稀盐酸反应,放出28.7 kJ的热量,则1molNaOH反应,放热28.7*2=57.4kJ。根据热化学方程式的书写原则进行判断。
A项, 的符号和数值均不正确。
的符号和数值均不正确。
B项, 的数值不正确。
的数值不正确。
C项, 的符号不正确。
的符号不正确。
D项,符合热化学方程式的书写原则,正确。
故选D
A项,
 的符号和数值均不正确。
的符号和数值均不正确。B项,
 的数值不正确。
的数值不正确。C项,
 的符号不正确。
的符号不正确。D项,符合热化学方程式的书写原则,正确。
故选D

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
 CH3CH2OH(g)+3H2O(g)发生的适宜条件,现改变氢碳比[n(H2)/n(CO2)]和温度等条件进行了如下实验:
CH3CH2OH(g)+3H2O(g)发生的适宜条件,现改变氢碳比[n(H2)/n(CO2)]和温度等条件进行了如下实验: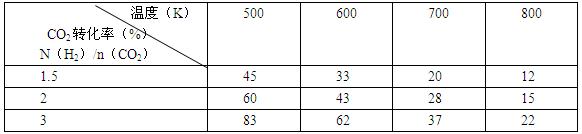
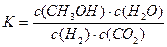
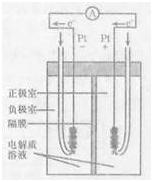
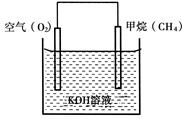

 CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表:
 ),容器内混合气体的密度 (填“增大”、“减小”或“不变”),气体平均相对分子质量 (填“增大”、“减小”或“不变”)。
),容器内混合气体的密度 (填“增大”、“减小”或“不变”),气体平均相对分子质量 (填“增大”、“减小”或“不变”)。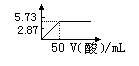
 2SO3(g) ΔH="-197" kJ·mol-1。在同一温度和压强下,向某密闭容器中通入2 mol SO4和1 mol O2达到平衡时,反应放出的热量为Q1,向另一相同的密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出的热量为Q2。下列关系正确的是( )
2SO3(g) ΔH="-197" kJ·mol-1。在同一温度和压强下,向某密闭容器中通入2 mol SO4和1 mol O2达到平衡时,反应放出的热量为Q1,向另一相同的密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出的热量为Q2。下列关系正确的是( )