题目内容
为验证SO2既有还原性又有氧化性,请用下面的仪器和试剂回答问题:可选用的试剂:①盐酸 ②溴水 ③Na2SO3 固体④FeS固体 ⑤品红试液 ⑥氢氧化钠溶液
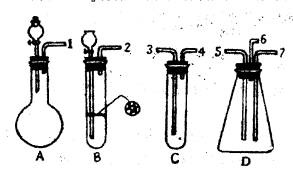
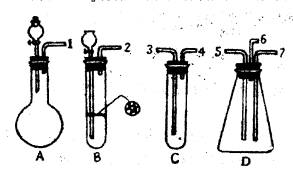
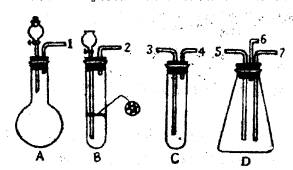
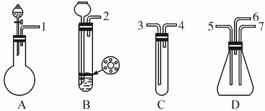
(1)表现SO2氧化性的实验是上述仪器中的 装置,实验中观察到的现象是 ,表现还原性的实验是上述仪器中的 装置,实验中观察到的现象是 。
(2)在装置A、B、C中应加入的试剂是(用试剂序号填写):A ,B ,C 。
(3)按SO2气流方向,用乳胶管(图中未画出)连接上述仪器组合成一套实验装置,正确的连接顺序是(用导管口序号填空): 。
(4)整套装置最后的气体出口导管应连接 这样处理的理由是
。
答案:
解析:
提示:
解析:
| (1)D;D装置有淡黄色固体细粒析出,并有水滴生成;C;溴水褪色。
(2)A:① ③ B:① ④ C:② (3)①—③,④—⑤,⑥—尾气吸收装置 (4)盛氢氧化钠溶液的尾气吸收装置;硫化氢和二氧化硫均有毒,防止其污染空气。
|
提示:
| 二氧化硫与硫化氢反应生成硫单质和水,体现出二氧化硫的氧化性,二氧化硫能使溴水褪色,体现出二氧化硫的还原性。根据题目提供的药品和仪器,A装置为二氧化硫的发生装置,烧瓶中应盛亚硫酸钠固体,分液漏斗中盛有盐酸,B为硫化氢的发生装置,试管中放入硫化亚铁固体,长颈漏斗中盛有盐酸,C中应盛有溴水,以验证二氧化硫的还原性。D是验证二氧化硫氧化性的装置。一端连接A,通入二氧化硫,一端连接B,通入硫化氢,尾气从b导出。因此按二氧化硫气流方向,上述仪器的连接顺序为①—③,④—⑤,⑥—尾气吸收装置。因为二氧化硫和硫化氢均有毒,排入空气造成污染,所以气体出口导管⑥应连接一盛有氢氧化钠溶液的尾气吸收装置。
|

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
 研究硫及其化合物性质有重要意义.
研究硫及其化合物性质有重要意义.