题目内容
【题目】常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤) 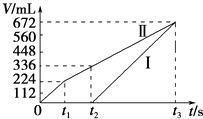
(1)原混合溶液中CuSO4的物质的量浓度.
(2)电解至t3时,消耗水的质量.
【答案】
(1)解:电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl﹣﹣2e﹣=Cl2↑、4OH﹣﹣4e﹣=O2↑+2H2O,阴极发生Cu2++2e﹣=Cu、2H++2e﹣=H2↑,结合图可知,Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系,
由图可知,产生氯气为224mL,则由2Cl﹣﹣2e﹣=Cl2↑可知,n(NaCl)= ![]() ×2=0.02mol,所以c(NaCl)=
×2=0.02mol,所以c(NaCl)= ![]() =0.1mol/L,
=0.1mol/L,
由t2时生成氧气为112mL,n(O2)= ![]() =0.005mol,则共转移电子为0.02mol+0.005mol×4=0.04mol,
=0.005mol,则共转移电子为0.02mol+0.005mol×4=0.04mol,
根据电子守恒及Cu2++2e﹣=Cu可知,n(CuSO4)= ![]() =0.02mol,所以c(CuSO4)=
=0.02mol,所以c(CuSO4)= ![]() =0.1mol/L,
=0.1mol/L,
答:原混合溶液NaCl和CuSO4的物质的量浓度均为0.1mol/L;
(2)解:电解至t3时,电解生成氧气为672﹣224mL=448mL,均来源于水,由2H2O ![]() O2↑+2H2↑,n(H2O)=
O2↑+2H2↑,n(H2O)= ![]() ×2=0.04mol,所以电解水的质量为0.04mol×18g/mol=0.72g,答:电解至t3时,消耗水的质量为0.72g.
×2=0.04mol,所以电解水的质量为0.04mol×18g/mol=0.72g,答:电解至t3时,消耗水的质量为0.72g.
【解析】电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl﹣﹣2e﹣=Cl2↑、4OH﹣﹣4e﹣=O2↑+2H2O,阴极发生Cu2++2e﹣=Cu、2H++2e﹣=H2↑,结合图可知,Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系,以此来计算.