题目内容
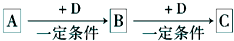 A、B、C、D均为中学化学中常见的物质,它们之间的转化关系如下图(部分产物已略去):试回答:
A、B、C、D均为中学化学中常见的物质,它们之间的转化关系如下图(部分产物已略去):试回答:(1)若D是具有氧化性的单质,A元素属于主族金属元素,则A的元素名称为
钠
钠
,C的电子式为

(2)若A是某物质的稀溶液,D是金属.
①A溶液中溶质的化学式为
HNO3
HNO3
;②C溶液在储存时应加入少量D,其理由是(用必要的文字和离子方程式表示)
2Fe3++Fe═3Fe2+
2Fe3++Fe═3Fe2+
;③B溶液中通入足量SO2气体反应的离子方程式为
Fe3++3NO3-+4H2O+5SO2═Fe2++3NO+5SO42++8H+
Fe3++3NO3-+4H2O+5SO2═Fe2++3NO+5SO42++8H+
.(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B.
请写出B转化为C的所有可能的离子方程式:
Al(OH)3+3H+═Al3++3H2O;Al(OH)3+OH-═AlO2-+2H2O
Al(OH)3+3H+═Al3++3H2O;Al(OH)3+OH-═AlO2-+2H2O
.分析:根据转化关系,A可以与D发生两步反应,可能发生的是氧化还原反应,或量不同产物不同的反应;
(1)若D是具有氧化性的单质,A元素属于主族金属元素,判断为:Na→Na2O→Na2O2,D为O2;
(2)若A是某物质的稀溶液,D是金属.说明金属具有变价,稀溶液具有氧化性,推断为:HNO3→Fe(NO3)3 →Fe(NO3)2;D为Fe;
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B.判断为:Al3+→Al(OH)3→AlO2-;D为OH-;或AlO2-→Al(OH)3→Al3+;D为H+.
(1)若D是具有氧化性的单质,A元素属于主族金属元素,判断为:Na→Na2O→Na2O2,D为O2;
(2)若A是某物质的稀溶液,D是金属.说明金属具有变价,稀溶液具有氧化性,推断为:HNO3→Fe(NO3)3 →Fe(NO3)2;D为Fe;
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B.判断为:Al3+→Al(OH)3→AlO2-;D为OH-;或AlO2-→Al(OH)3→Al3+;D为H+.
解答:解:(1)若D是具有氧化性的单质,A元素属于主族金属元素,判断为:Na→Na2O→Na2O2 A为Na;B为Na2O;C为Na2O2;D为O2;A的名称为:钠;C的电子式为 ,
,
故答案为:钠; ;
;
(2)若A是某物质的稀溶液,D是金属.说明金属具有变价,稀溶液具有氧化性,推断为:HNO3→Fe(NO3)3 →Fe(NO3)2;A为HNO3;B为Fe(NO3)3 ;C为Fe(NO3)2;D为Fe;
①A溶液中的溶质为氧化性酸硝酸:HNO3;
②C溶液为Fe(NO3)2;在储存时应加入少量铁,是防止Fe2+被氧化为Fe3+,2Fe3++Fe═3Fe2+;
③B溶液为Fe(NO3)3 ;通入足量SO2气体发生氧化还原反应,二氧化硫被三价铁离子和稀硝酸氧化为硫酸,反应的离子方程式:Fe3++3NO3-+4H2O+5SO2═Fe2++3NO+5SO42++8H+;
故答案为:①HNO3;②2Fe3++Fe═3Fe2+;③Fe3++3NO3-+4H2O+5SO2═Fe2++3NO+5SO42++8H+;
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B.判断为:Al3+→Al(OH)3→AlO2-;A为Al3+;B为Al(OH)3;C为AlO2-;D为NaOH;或AlO2-→Al(OH)3→Al3+;A、AlO2-;B、Al(OH)3;C、Al3+;D为H+;B转化为C的所有可能的离子方程式为生成氢氧化铝沉淀,在酸或碱中溶解的离子方程式,反应的离子方程式为:Al(OH)3+3H+═Al3++3H2O;Al(OH)3+OH-═AlO2-+2H2O;
故答案为:Al(OH)3+3H+═Al3++3H2O;Al(OH)3+OH-═AlO2-+2H2O.
 ,
,故答案为:钠;
 ;
;(2)若A是某物质的稀溶液,D是金属.说明金属具有变价,稀溶液具有氧化性,推断为:HNO3→Fe(NO3)3 →Fe(NO3)2;A为HNO3;B为Fe(NO3)3 ;C为Fe(NO3)2;D为Fe;
①A溶液中的溶质为氧化性酸硝酸:HNO3;
②C溶液为Fe(NO3)2;在储存时应加入少量铁,是防止Fe2+被氧化为Fe3+,2Fe3++Fe═3Fe2+;
③B溶液为Fe(NO3)3 ;通入足量SO2气体发生氧化还原反应,二氧化硫被三价铁离子和稀硝酸氧化为硫酸,反应的离子方程式:Fe3++3NO3-+4H2O+5SO2═Fe2++3NO+5SO42++8H+;
故答案为:①HNO3;②2Fe3++Fe═3Fe2+;③Fe3++3NO3-+4H2O+5SO2═Fe2++3NO+5SO42++8H+;
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B.判断为:Al3+→Al(OH)3→AlO2-;A为Al3+;B为Al(OH)3;C为AlO2-;D为NaOH;或AlO2-→Al(OH)3→Al3+;A、AlO2-;B、Al(OH)3;C、Al3+;D为H+;B转化为C的所有可能的离子方程式为生成氢氧化铝沉淀,在酸或碱中溶解的离子方程式,反应的离子方程式为:Al(OH)3+3H+═Al3++3H2O;Al(OH)3+OH-═AlO2-+2H2O;
故答案为:Al(OH)3+3H+═Al3++3H2O;Al(OH)3+OH-═AlO2-+2H2O.
点评:本题考查了物质转化关系的特征应用,物质性质的运用,主要考查铁及其化合物的性质,钠及其化合物的性质,铝及其化合物的性质,抓住转化特征,熟练掌握物质的性质是解题关键.

练习册系列答案
相关题目
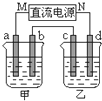 如图所示的装置中,甲、乙两烧杯中分别盛放有足量的CuSO4溶液和100g 10.00%的K2SO4溶液,a、b、c、d均为石墨电极.接通电源一段时间后,测得乙中K2SO4溶液浓度为10.47%,甲中a电极的质量增加.下列说法正确的是( )
如图所示的装置中,甲、乙两烧杯中分别盛放有足量的CuSO4溶液和100g 10.00%的K2SO4溶液,a、b、c、d均为石墨电极.接通电源一段时间后,测得乙中K2SO4溶液浓度为10.47%,甲中a电极的质量增加.下列说法正确的是( )| A、甲、乙溶液的pH均减小 | B、电极b上生成气体的体积约为2.8L(标准状况下) | C、电极d上发生的反应为:2H2O+2e-?H2↑+2OH- | D、欲使甲中的溶液恢复至原来的浓度,可加入24.5g的Cu(OH)2 |
 A、B、C、D均为常见物质,相互之间的关系如图所示.“-”表示两种物质间能发生反应,“→”表示物质间的转化关系,部分反应物或生成物以及反应条件已略去).
A、B、C、D均为常见物质,相互之间的关系如图所示.“-”表示两种物质间能发生反应,“→”表示物质间的转化关系,部分反应物或生成物以及反应条件已略去).
 A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素:A、B、C三种元素的原子序数之和为31;D元素与A、B、C三种元素既不是同周期,也不同主族.请回答:
A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素:A、B、C三种元素的原子序数之和为31;D元素与A、B、C三种元素既不是同周期,也不同主族.请回答:
 NH3?H2O+H+
NH3?H2O+H+ 2NH3
2NH3
 .甲和丙可形成两种化合物X和Y,X和水反应后生成一种具有还原性的二元酸M.1mol乙与足量丙可化合生成Z,所得的Z与热水反应的产物W需用12mol KOH才能完全中和.乙在足量丁中燃烧生成化合物N,N和水反应生成W和D元素的气态氢化物.试回答下列问题:
.甲和丙可形成两种化合物X和Y,X和水反应后生成一种具有还原性的二元酸M.1mol乙与足量丙可化合生成Z,所得的Z与热水反应的产物W需用12mol KOH才能完全中和.乙在足量丁中燃烧生成化合物N,N和水反应生成W和D元素的气态氢化物.试回答下列问题: