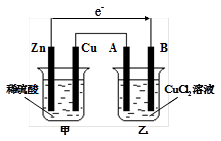
题目内容
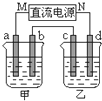 如图所示的装置中,甲、乙两烧杯中分别盛放有足量的CuSO4溶液和100g 10.00%的K2SO4溶液,a、b、c、d均为石墨电极.接通电源一段时间后,测得乙中K2SO4溶液浓度为10.47%,甲中a电极的质量增加.下列说法正确的是( )
如图所示的装置中,甲、乙两烧杯中分别盛放有足量的CuSO4溶液和100g 10.00%的K2SO4溶液,a、b、c、d均为石墨电极.接通电源一段时间后,测得乙中K2SO4溶液浓度为10.47%,甲中a电极的质量增加.下列说法正确的是( )| A、甲、乙溶液的pH均减小 | B、电极b上生成气体的体积约为2.8L(标准状况下) | C、电极d上发生的反应为:2H2O+2e-?H2↑+2OH- | D、欲使甲中的溶液恢复至原来的浓度,可加入24.5g的Cu(OH)2 |
分析:接通电源一段时间后,测得乙中K2SO4溶液浓度为10.47%,实质是电解水;甲池中电解硫酸铜溶液,甲中a电极的质量增加说明电解池中做阴极,电极反应为Cu2++2e-═Cu,b做阳极电极反应为4OH--4e-═2H2O+O2↑,c做阴极,电极反应为,2H++2e-═H2↑,d做阳极电极反应为4OH--4e-═2H2O+O2↑.
解答:解:A、甲溶液为硫酸铜溶液电极过程生成硫酸,溶液成酸性,pH减小,乙池电解硫酸钾溶液,实质电解水,溶液浓度增大,溶液pH不变,故A错误;
B、100g 10.00%的K2SO4溶液通电电解乙中K2SO4溶液浓度为10.47%,依据溶质不变计算电解水的质量为x,则100×10%=(100-x)×10.47%,得到x=4.49g,电解水物质的量=
=0.25mol,生成氢气为0.25mol,转移电子为0.5mol,电极b上的电极反应为,4OH--4e-═2H2O+O2↑,生成气体物质的量0.125mol,标准状况的体积约=0.125mol×22.4L/mol=2.8L(标准状况下),故B正确;
C、d做阳极电极反应为4OH--4e-═2H2O+O2↑,故C错误;
D、甲电解硫酸铜溶液,依据C分析电解过程中电子转移0.5mol,生成硫酸物质的量0.25mol,加入物质和硫酸反应生成0.25mol硫酸铜和0.25mol水,为欲使甲中的溶液恢复至原来的浓度,若加入24.5g的Cu(OH)2 物质的量=
=0.25mol,Cu(OH)2+H2SO4═CuSO4+2H2O,反应过程中生成的水多出一部分,故D错误;
故选:B.
B、100g 10.00%的K2SO4溶液通电电解乙中K2SO4溶液浓度为10.47%,依据溶质不变计算电解水的质量为x,则100×10%=(100-x)×10.47%,得到x=4.49g,电解水物质的量=
| 4.49g |
| 18g/mol |
C、d做阳极电极反应为4OH--4e-═2H2O+O2↑,故C错误;
D、甲电解硫酸铜溶液,依据C分析电解过程中电子转移0.5mol,生成硫酸物质的量0.25mol,加入物质和硫酸反应生成0.25mol硫酸铜和0.25mol水,为欲使甲中的溶液恢复至原来的浓度,若加入24.5g的Cu(OH)2 物质的量=
| 24.5g |
| 98g/mol |
故选:B.
点评:本题考查了电解池原理的分析应用,主要是电极反应和书写的方法,电子守恒的计算应用,溶液恢复是解题关键,题目难度中等.

练习册系列答案
相关题目
 目前流通的第五套人民币硬币材料分别为:1元硬币为铜芯镀镍合金,5角硬币为铜芯镀铜合金,1角硬币为硬铝合金.请回答:(题目中的百分含量均为质量分数)
目前流通的第五套人民币硬币材料分别为:1元硬币为铜芯镀镍合金,5角硬币为铜芯镀铜合金,1角硬币为硬铝合金.请回答:(题目中的百分含量均为质量分数)(1)钢是含碳量为0.03%~2%的
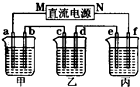
(2)如图所示的装置中,甲、乙、丙三个烧杯分别盛放足量的溶液,电极及溶液如下表所示:
| 电极 | a | b | c | d | e | f |
| 石墨 | 石墨 | 铜 | 钢 | 钢 | 铜 | |
| 溶液 | NaCl溶液 | CuSO4溶液 | CuSO4溶液 | |||
①上述装置中M极为直流电源的
②若在钢币上镀铜,应选择
(3)工业上以铝土矿(主要成分Al2O3?nH2O,含少量的氧化铁和石英等杂质)为原料生产铝.为除去铝土矿样品中氧化铁和石英杂质,要将粉碎、筛选后的铝土矿样品溶解在足量的氢氧化钠溶液中处理,请写出有关反应的离子方程式
(4)已知硬铝中含Cu:2.2%~5%、Mg:0.2%~3%、Mn:0.3%~1.5%、Si:0.5%,其余是Al.1角硬币单枚质量为2.20克,若想制得1角硬币1百万枚,理论上至少需要含Al2O3 90%的铝土矿约
 目前流通的第五套人民币硬币材料分别为:1元硬币为铜芯镀镍合金,5角硬币为铜芯镀铜合金,1角硬币为硬铝合金.请回答:(题目中的百分含量均为质量分数)
目前流通的第五套人民币硬币材料分别为:1元硬币为铜芯镀镍合金,5角硬币为铜芯镀铜合金,1角硬币为硬铝合金.请回答:(题目中的百分含量均为质量分数)
(1)钢是含碳量为0.03%~2%的______(填物质类别名称).
(2)如图所示的装置中,甲、乙、丙三个烧杯分别盛放足量的溶液,电极及溶液如下表所示:
| 电极 | a | b | c | d | e | f |
| 石墨 | 石墨 | 铜 | 钢 | 钢 | 铜 | |
| 溶液 | NaCl溶液 | CuSO4溶液 | CuSO4溶液 | |||
①上述装置中M极为直流电源的______极(填“正”或“负”),电极b上发生的电极反应式为______.
②若在钢币上镀铜,应选择______烧杯(填“乙”或“丙”),当电极a上生成标准状况下气体2240mL时,理论上可在电极______(填字母)上镀铜______g.
(3)工业上以铝土矿(主要成分Al2O3?nH2O,含少量的氧化铁和石英等杂质)为原料生产铝.为除去铝土矿样品中氧化铁和石英杂质,要将粉碎、筛选后的铝土矿样品溶解在足量的氢氧化钠溶液中处理,请写出有关反应的离子方程式______.
(4)已知硬铝中含Cu:2.2%~5%、Mg:0.2%~3%、Mn:0.3%~1.5%、Si:0.5%,其余是Al.1角硬币单枚质量为2.20克,若想制得1角硬币1百万枚,理论上至少需要含Al2O3 90%的铝土矿约______吨(小数点后保留一位数字).