题目内容
17.如图:关于乙醇在各种反应中断裂键的说法不正确的是( )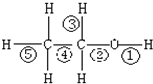
| A. | 乙醇和钠反应,键①断裂 | |
| B. | 在Ag催化下和O2反应,键①③断裂 | |
| C. | 乙醇完全燃烧时键①②断裂 | |
| D. | 醇和浓H2SO4共热,在140℃时,键①或键②断裂;在170℃时,键②⑤断裂 |
分析 A.金属钠与乙醇反应取代羟基上氢原子,断开的羟基上的氢氧键;
B.乙醇在Ag催化下与O2反应生成乙醛和水,断开的是羟基上的氢氧键和与羟基所连的碳的氢;
C.燃烧时所有的化学键发生断裂;
D.乙醇与浓硫酸共热至140℃发生分子间脱水;醇与浓硫酸共热至170℃发生消去反应.
解答 解:A.乙醇含有-OH,可发生取代反应,乙醇和金属钠反应乙醇钠和氢气,2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,键①断裂,故A正确;
B.乙醇在Ag催化下与O2反应生成乙醛和水:2CH3CH2OH+O2→2CH3CHO+2H2O,故乙醇断键的位置为①和③,故B正确;
C.在空气中完全燃烧时生成二氧化碳和水,则断裂①②③④⑤,故C错误;
D.乙醇与浓硫酸共热至140℃发生分子间脱水,一个乙醇脱去羟基,另一个乙醇脱去羟基上的氢,即键①或键②断裂;醇与浓硫酸共热至170℃发生消去反应,脱去羟基和相邻碳原子上的氢,即键②、⑤断裂,故D正确;
故选C.
点评 乙醇的性质是高考热点题型,每年必考.本题重点考查了乙醇发生化学反应式键的断裂情况.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
7.为了同时除去混在CO2气体中的杂质HCl和SO2,应选用的试剂是( )
| A. | NaOH溶液 | B. | 饱和NaHCO3溶液 | C. | Na2CO3溶液 | D. | CaO固体粉末 |
8.下列变化中,肯定发生了化学变化的是( )
| A. | 干冰升华 | B. | 石油分馏 | C. | 粗盐潮解 | D. | 高梁酿酒 |
5.下列一种变化与其它三种变化有本质区别,这种变化是( )
| A. | 碳燃烧产生气体 | B. | 硫燃烧产生气体 | ||
| C. | 高锰酸钾加热产生气体 | D. | 水加热产生气体 |
12.下列说法中不正确的是( )
| A. | 1mol CH≡CH可以与Br2发生加成反应,消耗2 molBr2 | |
| B. | 苯的邻位二元取代物只有一种可以说明苯分子不具有碳碳单键和碳碳双键的交替结构 | |
| C. | 甲苯(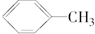 )中所有原子都在同一平面内 )中所有原子都在同一平面内 | |
| D. | 己烷的沸点高于2-甲基戊烷 |
2.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 在标准状况下,0.5 molNO与0.5 molO2混合后气体分子数为0.75NA | |
| B. | 常温常压下,14g的C2H4和C4H8混合气体中含有的原子数为3 NA | |
| C. | 0.1molAlCl3完全转化为氢氧化铝胶体,生成O.l NA个胶体粒子 | |
| D. | 1.0 L1.0 mol.L-lNa2 SiO3水溶液中含有的氧原子数为3 NA |
9.据报道,科学家发现了一种新元素,它的原子核内有159个中子,质量数为275,该元素原子的核外电子数为( )
| A. | 111 | B. | 116 | C. | 272 | D. | 433 |
6.下列说法不正确的是( )
| A. | “煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气 | |
| B. | 汽车尾气催化转化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,有利于提高该反应的平衡转化率 | |
| C. | 2014年诺贝尔化学奖授予美国科学家埃里克•贝齐格、威廉•莫纳和德国科学家斯特凡•黑尔,以表彰他们为发展超分辨率荧光显微镜所作的贡献,利用此类显微镜可以观察病毒以及活细胞内蛋白质等大分子 | |
| D. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油,实现厨余废物合理利用 |
2.两位美国科学家因“G蛋白偶联受体研究”获得2012诺贝尔化学奖,关与蛋白质的有关说法中,错误的是( )
| A. | 属于高分子化合物 | |
| B. | 水解后可得到多种氨基酸 | |
| C. | 可以采用多次盐析或多次渗析的方法分离、提纯蛋白质 | |
| D. | 加入CuSO4溶液后所得的沉淀能溶于水 |