题目内容
17.在下列药品中:①FeCl2溶液;②AgNO3溶液;③金属Na;④氯水;⑤稀氢氧化钠溶液;⑥浓硝酸.(1)应保存在广口瓶中的是③,应保存在棕色细口瓶中的是②④⑥;
(2)需要现用现配的是①④;
(3)不能保存在带磨口塞的玻璃瓶中的是⑤;
(4)取出使用后有剩余可再放回原试剂瓶的是③.
分析 (1)固体存放在广口瓶中,见光易分解的物质需避光保存;
(2)容易变质的药品要现用现配;
(3)氢氧化钠与空气中二氧化碳反应生成具有粘性的物质,不易用玻璃塞;
(4)金属钠、钾等剩余后要放回原瓶.
解答 解:(1)③金属Na为固体药品,应存放在广口瓶中,硝酸银、浓硝酸以及氯水见光容易分解,需保存在棕色试剂瓶中,故答案为:③;②④⑥;
(2)在空气中容易变质的物质需要现用现配,不利于存放或有毒的药品需要现用现配,故答案为:①④;
(3)氢氧化钠长时间存放容易粘连玻璃塞,需要保存在橡胶塞的试剂瓶中,故答案为:⑤;
(4)金属钠、钾等,剩余后不能随意处理,需要放回原瓶,故答案为:③.
点评 化学试剂存放要依据物质自身的物理性质和化学性质,降低或杜绝物质变性、自然损耗,方便试剂取用是我们的总原则.因此我们要考虑试剂瓶瓶质、瓶口、瓶塞、瓶体颜色、防护性试剂与环境措施等诸多方面的问题,本题难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
8.下列叙述正确的是( )
| A. | ${\;}_{8}^{16}$O2和${\;}_{8}^{18}$O2互为同位素,性质相似 | |
| B. | 铁放入稀硫酸中,再加入硝酸钠可以加快放出氢气的速率 | |
| C. | 明矾和漂白粉常用于自来水净化和杀菌消毒,两者作用原理相同 | |
| D. | C(石墨,s)=C(金刚石,s)△H>0,所以石墨比金刚石稳定 |
5.把氯气通入紫色石蕊试液中,出现的现象是( )
| A. | 试液最终变为红色 | B. | 试液不变色 | ||
| C. | 试液直接褪为无色 | D. | 试液先变红,后褪色 |
18.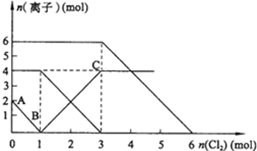 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-;2Fe3++2I-═2Fe2++I2.则下列有关说法中,不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-;2Fe3++2I-═2Fe2++I2.则下列有关说法中,不正确的是( )
 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-;2Fe3++2I-═2Fe2++I2.则下列有关说法中,不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-;2Fe3++2I-═2Fe2++I2.则下列有关说法中,不正确的是( )| A. | BC段为Fe3+的变化曲线 | |
| B. | 原混合溶液中FeBr2的物质的量为6mol | |
| C. | 当通入2mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| D. | 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
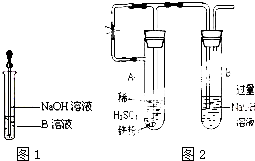 某同学利用右图所示装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质.
某同学利用右图所示装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质.