题目内容
【题目】某化工厂每小时生产a 吨98%(质量分数)硫酸。为使硫充分燃烧,且在下一步催化氧化时不再补充空气,要求燃烧后的混合气体中含氧气的体积分数为b%。若空气中氧气的体积分数为21%,且不考虑各生产阶段的物料损失,则
(1)该厂每小时消耗标准状况下空气的体积为___________m3。
(2)为满足题设要求,b%的下限等于___________。
【答案】![]() 7%
7%
【解析】
根据S+O2=SO2反应前后气体体积不变,求出燃烧后O2的体积。
(1)每小时生产的纯硫酸为(a×106g×98%)÷98g/mol=a×104mol。生产过程中生成的SO2和SO3也都是a×104mol。设每小时消耗空气的体积为V,则由S+O2=SO2消耗O2的体积等于生成的SO2体积,即燃烧前空气的体积等于燃烧后混合气体的体积,据此可得以下关系:空气中O2的体积=反应中消耗的O2的体积+燃烧后混合气体中O2的体积,即V×21%=a×104mol×22.4L·mol-1×10-3m3·L-1+V×b%,V=![]() m3。
m3。
(2)“b的下限”,其含义是指燃烧后剩余的O2在第二步催化氧化时恰好完全反应,也就是说,燃烧前空气中的氧(空气体积的21%)恰好满足两步反应。因S+O2=SO2和O2+2SO2=2SO3两步反应耗O2之比为2:1,故燃烧后(第一步反应后)混合气体中O2的体积分数的下限是b%=![]() ×21%=7%。
×21%=7%。

 名校课堂系列答案
名校课堂系列答案【题目】某兴趣小组利用文献资料设计方案对氯及其化合物进行探究。
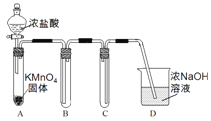
Ⅰ.用高锰酸钾和浓盐酸反应制取氯气
(1)该小组利用右图装置及试剂制备并收集适量Cl2,装置B、C的作用分别是___________、_______________。
(2)制得的氯气中加入适量水,得到饱和氯水,饱和氯水中含氯元素的微粒有____________(写出全部微粒)。
(3)饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一。在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强。
①滤液漂白性增强的原因是________________(用化学平衡移动原理解释)。
②饱和氯水与石灰石反应生成HC1O的方程式是___________________。
Ⅱ. ClO3—、Cl—和H+反应的探究
(4)KClO3、KCl与硫酸可以反应。该小组设计了系列实验研究反应条件对反应的影响,实验记录如下(实验在室温下进行):
烧杯编号 | 1 | 2 | 3 | 4 |
氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
氯化钾固体 | 1g | 1g | 1g | 1g |
水 | 8mL | 6mL | 3mL | 0mL |
硫酸(6mol/L) | 0mL | 2mL | (____)mL | 8mL |
现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色, |
①该系列实验的目的_______________________。
②烧杯3取用硫酸的体积应为______________mL。
(5)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色。设计最简单的实验验证Cl2中含有ClO2______________________。

