题目内容
实验室模拟合成氨和氨催化氧化的流程如下:
(1)已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气,该反应中只有氮元素发生变价,写出该反应的化学方程式
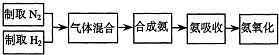
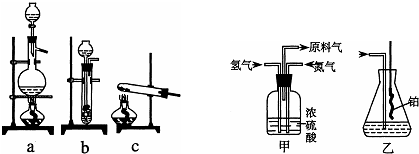
从图1中选择制取氮气的合适装置
(2)如图2氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有
(3)如图2用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:
(4)反应结束后锥形瓶内的溶液中含有H+、OH-、

(1)已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气,该反应中只有氮元素发生变价,写出该反应的化学方程式
NaNO2+NH4Cl
N2↑+2H20+NaCl
| ||
NaNO2+NH4Cl
N2↑+2H20+NaCl
.
| ||
从图1中选择制取氮气的合适装置
a
a
.
(2)如图2氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有
控制氢气和氮气的流速
控制氢气和氮气的流速
干燥气体
干燥气体
.(3)如图2用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:
氨的氧化反应是一个放热反应,放出的热使铂丝保持红热
氨的氧化反应是一个放热反应,放出的热使铂丝保持红热
,锥形瓶中还可观察到的现象是:有红棕色气体产生
有红棕色气体产生
.(4)反应结束后锥形瓶内的溶液中含有H+、OH-、
NH4+、NO3-
NH4+、NO3-
离子.分析:(1)根据题干信息可知:反应物是NaNO2和NH4Cl,有N2生成,反应中只有氮元素发生变价,结合质量守恒定律可知:生成物还有NaCl和H2O,然后进行配平即可,注意反应条件.
根据反应物的状态与反应条件选择发生装置.
(2)甲装置的作用有将气体混合均匀、控制氢气和氮气的流速、干燥气体.
(3)氨的氧化反应是一个放热反应;生成的一氧化氮与空气中的氧气化合成二氧化氮.
(4)锥形瓶内氮的氧化物与水反应生成硝酸,硝酸再与氨水反应生成硝酸铵.
根据反应物的状态与反应条件选择发生装置.
(2)甲装置的作用有将气体混合均匀、控制氢气和氮气的流速、干燥气体.
(3)氨的氧化反应是一个放热反应;生成的一氧化氮与空气中的氧气化合成二氧化氮.
(4)锥形瓶内氮的氧化物与水反应生成硝酸,硝酸再与氨水反应生成硝酸铵.
解答:解:(1)根据质量守恒定律及题干信息可知,反应物是NaNO2和NH4Cl,生成物是N2和H2O和NaCl,用观察法配平即可.
反应方程式为NaNO2+NH4Cl
N2↑+2H20+NaCl.该反应为溶液加热制备气体,发生装置选择a.
故答案为:NaNO2+NH4Cl
N2↑+2H20+NaCl;a.
(2)甲装置的作用有将气体混合均匀、控制氢气和氮气的流速、干燥气体.
故答案为:控制氢气和氮气的流速、干燥气体.
(3)氨的氧化反应是一个放热反应,放出的热使铂丝保持红热;
生成的一氧化氮与空气中的氧气化合成二氧化氮,二氧化氮是红棕色气体.
故答案为:氨的氧化反应是一个放热反应,放出的热使铂丝保持红热;有红棕色气体产生.
(4)锥形瓶内氮的氧化物与水反应生成硝酸,硝酸再与氨水反应生成硝酸铵.所以锥形瓶内溶液含有硝酸铵.
所以溶液中含有H+、OH-、NH4+、NO3-离子.
故答案为:NH4+、NO3-离子.
反应方程式为NaNO2+NH4Cl
| ||
故答案为:NaNO2+NH4Cl
| ||
(2)甲装置的作用有将气体混合均匀、控制氢气和氮气的流速、干燥气体.
故答案为:控制氢气和氮气的流速、干燥气体.
(3)氨的氧化反应是一个放热反应,放出的热使铂丝保持红热;
生成的一氧化氮与空气中的氧气化合成二氧化氮,二氧化氮是红棕色气体.
故答案为:氨的氧化反应是一个放热反应,放出的热使铂丝保持红热;有红棕色气体产生.
(4)锥形瓶内氮的氧化物与水反应生成硝酸,硝酸再与氨水反应生成硝酸铵.所以锥形瓶内溶液含有硝酸铵.
所以溶液中含有H+、OH-、NH4+、NO3-离子.
故答案为:NH4+、NO3-离子.
点评:本题以信息形式主要考查了氮气的制取、以及氮的化合物的性质,综合性较大,旨在考查学生对知识的迁移运用,依据已有的知识进行.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目