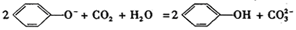题目内容
将氢氧化钠溶液滴入Ca(HCO3)2溶液中,可能发生反应的离子方程式为
| A.H+ + OH- →H2O |
| B.HCO3- + Ca2+ + OH- → CaCO3↓ + H2O |
| C.HCO3- + OH- → CO32- + H2O |
| D.2HCO3- + Ca2+ + 2OH- → CaCO3↓+ 2H2O + CO32- |
BD
分析:将氢氧化钠溶液滴入Ca(HCO3)2溶液中,NaOH不足,则发生HCO3-+Ca2++OH-═CaCO3↓+H2O,若NaOH过量,
则发生2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32-,以此来解答.
解:NaOH、Ca(HCO3)2均为强电解质,
①若NaOH少量,滴入Ca(HCO3)2溶液中,NaOH完全反应,则离子反应为HCO3-+Ca2++OH-═CaCO3↓+H2O,
②若NaOH过量,滴入Ca(HCO3)2溶液中,Ca(HCO3)2完全反应,则离子反应为
2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32-,
故选BD.

练习册系列答案
相关题目
 Cl2↑+H2↑+OH-
Cl2↑+H2↑+OH-