题目内容
【题目】某酸性溶液中只有Na+、CH3COO﹣、H+、OH﹣四种离子.则下列描述正确的是
A. 该溶液可由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B. 该溶液可由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C. 加入适量NaOH,溶液中离子浓度为c(CH3COO﹣)>c(Na+ )>c(OH﹣)>c(H+)
D. 加入适量氨水,c(CH3COO﹣)一定大于c(Na+)、c(NH4+)之和
【答案】A
【解析】试题分析:pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,CH3COOH过量,溶液显酸性,故A项有可能。等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合后生成CH3COONa水解显碱性,B项不可能。C选项不符合电荷守恒,故不可能。加入适量氨水后的溶液中电荷守恒关系为:c(Na+)+c(NH![]() )+c(H+)=c(OH-)+c(CH3COO-)因为此时溶液酸碱性未知,故不能判断c(H+)与c(OH-)的相对大小,即不能判断c(CH3COO-)与c(Na+)和c(NH4+)之和的大小关系。
)+c(H+)=c(OH-)+c(CH3COO-)因为此时溶液酸碱性未知,故不能判断c(H+)与c(OH-)的相对大小,即不能判断c(CH3COO-)与c(Na+)和c(NH4+)之和的大小关系。

【题目】工业上利用回收的合金废料(主要含Fe、Cu、Co、Si、Li)进行深度加工的工艺流程如图:
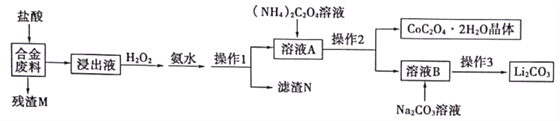
已知:①Fe、Co、Ni为同族元素,化学性质相似
②Li2CO3微溶于水,其饱和溶液的物质的量浓度与温度关系如表所示
温度/℃ | 10 | 30 | 60 | 90 |
浓度/mol/L | 0.21 | 0.17 | 0.14 | 0.10 |
回答下列问题:
(1)流程中残渣M的主要成分为____。
(2)“浸出液”中加入H2O2后,为检测Fe2+是否完全被氧化,最佳试剂为____;加入氨水发生反应的离子方程式为_________________。
(3)为减少Li2CO3的溶解损失,“操作3”应为蒸发浓缩、______、洗涤、干燥。
(4)将CoC2O4·2H2O样品于空气中加热,样品质量随温度变化的曲线如图所示,曲线中300℃及以上所得固体为钴的氧化物。实验室中应置于______(填仪器名称)焙烧样品。通过计算确定C点剩余固体的化学成分为_______;试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式:_______________。

