题目内容
13.下列有关胶体知识叙述正确的组合是( )①水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染
②胶体区别于其他分散系的本质特征是分散质颗粒直径大小
③区分胶体和其他分散系的最简便方法是利用丁达尔效应
④往Fe(OH)3胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解
⑤医院里用血液透析的方法治疗肾功能衰竭等疾病引起的血液中毒
⑥FeCl3溶液和小苏打溶液混合会产生红褐色沉淀和无色气体
⑦同一支钢笔先后吸入不同牌子的墨水易造成钢笔堵塞
⑧胶体具有介稳性的主要原因是胶体粒子可以通过吸附而带有电荷,且同种胶体粒子的电性相同
⑨在Fe(OH)3胶体中,Fe(OH)3胶体粒子的数目要远远小于原FeCl3溶液中Fe3+的数目.
| A. | ①②③④⑦⑥⑧ | B. | ①②④⑤⑦⑧⑨ | C. | ①③④⑤⑦⑧ | D. | ①②③④⑤⑦⑧⑨ |
分析 ①灰尘是胶体,属于气溶胶,有电泳的性质;
②根据胶体区别于其他分散系的本质特征是分散质的微粒直径大小;
③胶体具有丁达尔效应而溶液不具备;
④胶体遇电解质溶液发生聚沉;
⑤血液属于胶体;
⑥NaHCO3溶液和FeCl3溶液混合发生双水解生成氢氧化铁沉淀和二氧化碳气体;
⑦墨水是胶体;
⑧因为胶体粒子通过吸附离子而带相同电荷,胶体粒子间相互排斥使它们不易聚沉;
⑨胶体微粒是氢氧化铁的集合体.
解答 解:①灰尘是胶体,在外加电源作用下,有电泳的性质,与胶体性质有关,故①正确;
②胶体区别于其他分散系的本质特征是分散质的微粒直径大小,胶体分散系的微粒直径在1~100nm之间,故②正确;
③胶体和溶液可以用丁达尔现象鉴别,光线通过时胶体出现光亮的通路,溶液无现象,故③正确;
④稀硫酸是电解质溶液,氢氧化铁胶体遇电解质溶液发生聚沉,与胶体性质有关,故④正确;
⑤血液属于胶体,使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血应用了胶体聚沉的原理,故⑤正确;
⑥NaHCO3溶液和FeCl3溶液混合发生双水解生成氢氧化铁沉淀和二氧化碳气体,与胶体性质无关,故⑥错误;
⑦带相反电荷的胶体混合发生聚沉,故⑦正确;
⑧胶体粒子带有电荷,粒子间相互排斥,具有介稳性,故⑧正确;
⑨胶体微粒是氢氧化铁的集合体,Fe(OH)3胶体粒子的数目要远远小于原FeCl3溶液中Fe3+的数目,故⑨正确.
故选D.
点评 本题考查胶体的性质,明确胶体常见的性质有丁达尔现象、胶体的聚沉、电泳等,利用胶体性质对生产生活中实际问题进行解释,题目难度不大.

练习册系列答案
相关题目
3.只用一种试剂,可以一次性鉴别NH4Cl、NaCl、Na2SO4三种溶液,这种试剂是( )
| A. | Ba(OH)2溶液 | B. | KCl溶液 | C. | 酚酞溶液 | D. | 盐酸 |
4.某酯在稀硫酸中水解得到甲和乙,且甲和乙的相对分子量相等,则该酯可能为( )
| A. | 甲酸甲酯 | B. | 乙酸乙酯 | C. | 甲酸乙酯 | D. | 乙酸甲酯 |
1.下列应用与盐类的水解无关的是( )
| A. | 纯碱溶液可去除油污 | |
| B. | FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体 | |
| C. | TiCl4溶于大量水加热制备TiO2 | |
| D. | 保存FeSO4溶液时加入少量铁粉 |
8. 25℃时,部分物质的电离常数如表所示:
25℃时,部分物质的电离常数如表所示:
请回答下列问题:
(1)a.CH3COOH,b.H2CO3,c.HClO的酸性由强到弱的顺序为a>b>c(填编号).
(2)同浓度的a.CH3COO-,b.HCO${\;}_{3}^{-}$,c.CO${\;}_{3}^{2-}$,d.ClO-结合H+的能力由强到弱的顺序为c>d>b>a(填编号).
(3)向NaClO溶液中通入少量的CO2,反应的离子方程式为ClO-+CO2+H2O=HCO3-+HClO.
(4)pH相同的下列四种物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,物质的量浓度由大到小的顺序是c>d>b>a(填编号).
(5)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A(填序号).
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-) D. c(H+)•c(CH3COO-)/c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是ABCD.
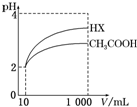
(6)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离常数大于(填“大于”、“等于”或“小于”)醋酸的电离常数;稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+).
 25℃时,部分物质的电离常数如表所示:
25℃时,部分物质的电离常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)a.CH3COOH,b.H2CO3,c.HClO的酸性由强到弱的顺序为a>b>c(填编号).
(2)同浓度的a.CH3COO-,b.HCO${\;}_{3}^{-}$,c.CO${\;}_{3}^{2-}$,d.ClO-结合H+的能力由强到弱的顺序为c>d>b>a(填编号).
(3)向NaClO溶液中通入少量的CO2,反应的离子方程式为ClO-+CO2+H2O=HCO3-+HClO.
(4)pH相同的下列四种物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,物质的量浓度由大到小的顺序是c>d>b>a(填编号).
(5)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A(填序号).
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-) D. c(H+)•c(CH3COO-)/c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是ABCD.
(6)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离常数大于(填“大于”、“等于”或“小于”)醋酸的电离常数;稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+).
18.下列化学反应的离子方程式正确的是( )
| A. | FeO溶于稀HNO3中 3FeO+10H++NO${\;}_{3}^{-}$═3Fe3++NO↑+5H2O | |
| B. | NH4HSO4溶液与少量的NaOH稀溶液的反应:NH4++H++2OH-═H2O+NH3•H2O | |
| C. | Ba(OH)2溶液与NaHSO4溶液的反应溶液呈中性:Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O | |
| D. | 0.01 mol•L-1 NH4Al(SO4)2溶液与0.02 mol•L-1 Ba(OH)2溶液等体积混合:Al3++2Ba2++4OH-+2SO${\;}_{4}^{2-}$═2BaSO4↓+AlO${\;}_{2}^{-}$+2H2O |
5. 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
(1)若用浓盐酸与高锰酸钾为原料制取Cl2,则反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(2)B仪器的作用是使挥发的产物SO2Cl2冷凝回流;
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择A;
A.冰水浴 B.常温 C.加热至69.1℃D.沸水浴
(4)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应.充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收.分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W.
经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式SO2Cl2+2H2O=H2SO4+2HCl;反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥,称量得到的固体质量分别为X g、Y g.计算SO2+Cl2?SO2Cl2反应中,SO2的转化率为(用含X、Y的代数式表示)$\frac{x}{x+y}$×100%.
 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.| SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生剧烈水解 |
(2)B仪器的作用是使挥发的产物SO2Cl2冷凝回流;
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择A;
A.冰水浴 B.常温 C.加热至69.1℃D.沸水浴
(4)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应.充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收.分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W.
经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式SO2Cl2+2H2O=H2SO4+2HCl;反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥,称量得到的固体质量分别为X g、Y g.计算SO2+Cl2?SO2Cl2反应中,SO2的转化率为(用含X、Y的代数式表示)$\frac{x}{x+y}$×100%.