题目内容
将4 mol SO3气体和4 molNO置于2L容器中,一定条件下发生如下可逆反应(不考虑NO2和N2O4之间的相互转化):2SO3(g) 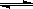 2SO2+O2、2NO+O2
2SO2+O2、2NO+O2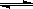 2NO2
2NO2
⑴当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)="0.1" mol、n(NO2)="3.6" mol,则此时SO3气体的物质的量为 。
⑵当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和 ,或NO和 (填它们的分子式)。
⑶在其它条件不变的情况下,若改为起始时在1 L容器中充入2 molNO2和2 molSO2,则上述两反应达到平衡时,c(SO2)平= mol/L。
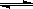 2SO2+O2、2NO+O2
2SO2+O2、2NO+O2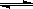 2NO2
2NO2⑴当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)="0.1" mol、n(NO2)="3.6" mol,则此时SO3气体的物质的量为 。
⑵当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和 ,或NO和 (填它们的分子式)。
⑶在其它条件不变的情况下,若改为起始时在1 L容器中充入2 molNO2和2 molSO2,则上述两反应达到平衡时,c(SO2)平= mol/L。
⑴0.2 mol ⑵SO2、NO2 ⑶1.9
(1)NO2的物质的量是3.6mol,则消耗氧气的物质的量是1.8mol,所以最初生成的氧气是1.9mol,则分解的三氧化硫是3.8mol,所以平衡时三氧化硫的物质的量是0.2mol。
(2)根据原子守恒可知,两种气体一定不能同时是三氧化硫和二氧化硫,以及NO和NO2。
(3)根据题意可知,此时平衡一定是等效的,所以平衡时SO2的浓度还是1.9mol/L。
(2)根据原子守恒可知,两种气体一定不能同时是三氧化硫和二氧化硫,以及NO和NO2。
(3)根据题意可知,此时平衡一定是等效的,所以平衡时SO2的浓度还是1.9mol/L。

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
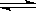 CO(g)+H2(g),其平衡常数表达式正确的是( )
CO(g)+H2(g),其平衡常数表达式正确的是( )
 C(g)+D(g) 已知,平衡时,Ca(A)·C(B)= C(C)·C(D),然后在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,则B的转化率是 ( )
C(g)+D(g) 已知,平衡时,Ca(A)·C(B)= C(C)·C(D),然后在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,则B的转化率是 ( )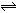 N2O4 △H<0,若把烧瓶置于100℃的沸水中,下列情况:①颜色,②平均相对分子质量,③质量,④压强,⑤密度,其中不变的是( )
N2O4 △H<0,若把烧瓶置于100℃的沸水中,下列情况:①颜色,②平均相对分子质量,③质量,④压强,⑤密度,其中不变的是( )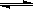 2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是
2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是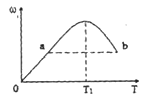
 Y(g)+Z(s),以下能说明反应达到平衡标志的( )
Y(g)+Z(s),以下能说明反应达到平衡标志的( ) pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是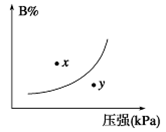
 3C(g)+D(g),达到平衡时容器内D的百分含量为a%。若保持容器体积和温度不变,分别通入下列几组物质达到平衡时容器内D的百分含量也为a%的是( )
3C(g)+D(g),达到平衡时容器内D的百分含量为a%。若保持容器体积和温度不变,分别通入下列几组物质达到平衡时容器内D的百分含量也为a%的是( )