题目内容
如图是CsCl晶体的晶胞结构(晶体中最小重复单元),已知晶体中两个最近的Cs+核间距离为a cm,氯化铯的式量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )。
A. g·cm-3 g·cm-3 | B. g·cm-3 g·cm-3 |
C. g·cm-3 g·cm-3 | D. g·cm-3 g·cm-3 |
C
解析

练习册系列答案
相关题目
水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165K(零下108℃)时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是( )
| A.水由液态变为玻璃态,体积缩小 |
| B.玻璃态水变成冰发生化学变化 |
| C.玻璃态是水的一种特殊状态 |
| D.玻璃态水与冰的化学性质不同 |
已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的的是
| A.ZXY3 | B.ZX2Y6 | C.ZX4Y8 | D.ZX8Y12 |
已知A、B、C、D、E五种元素的性质或结构信息如下,请根据信息回答下列问题:
(1)已知短周期元素A、B原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |

②ACl2分子中A的杂化类型为__________,ACl2空间构型为__________。
(2)已知C单质曾被称为“银色的金子”,与锂形成的合金常用于航天飞行器,其单质能溶于强酸和强碱。D是周期表中电负性最大的元素。E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物。请根据上述信息。
①写出E元素原子基态时的电子排布式____________________。
②以C单质、镁、NaOH溶液可以构成原电池,则负极的电极反应式为__________。
③D与Ca2+可形成离子化合物,其晶胞结构如图所示。其中Ca2+离子的配位数为__________,若该晶体的密度为ag/cm3,则该晶胞的体积是__________cm3(写出表达式即可)。

最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性,因这三种元素都是常见元素,从而引起广泛关注。该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为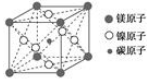
| A.Mg2CNi3 | B.MgCNi3 | C.MgCNi2 | D.MgC2Ni |
下列说法中正确的是(NA为阿伏加德罗常数)( )
| A.28 g晶体硅中含有Si—Si键的个数为2NA |
| B.124 g白磷(P4)晶体中含有P—P键的个数为4NA |
| C.12 g金刚石中含有C—C键的个数为4NA |
| D.SiO2晶体中每1 mol Si可与氧原子形成2NA个共价键(Si—O键) |
下列物质属于非晶体的是( )。
①松香;②冰;③石英;④沥青;⑤铜;⑥纯碱
| A.①②③④⑤⑥ | B.①④ | C.①③ | D.⑤⑥ |
要使金属晶体熔化必须破坏其中的金属键。金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱,而金属键的强弱与金属阳离子所带电荷的多少及半径大小相关。由此判断下列说法正确的是( )。
| A.金属镁的硬度大于金属铝 |
| B.碱金属单质的熔、沸点从Li到Cs是逐渐增大的 |
| C.金属镁的熔点大于金属钠 |
| D.金属镁的硬度小于金属钙 |
下列性质中体现了金属通性的是( )。
| A.铁能够被磁铁磁化 |
| B.铝常温下不溶于浓硝酸 |
| C.铜有良好的延展性、导热性和导电性 |
| D.钠与水剧烈反应放出氢气 |