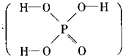
题目内容
【题目】下列关于Na2CO3与NaHCO3固体性质比较中,正确的是( )
A.常温时,等浓度的溶液的碱性:Na2CO3<NaHCO3
B.二者均可与澄清石灰水反应生成白色沉淀
C.与同浓度的盐酸反应放出气体的速率快慢:Na2CO3>NaHCO3
D.等质量的Na2CO3和NaHCO3分别与过量的盐酸反应,产物CO2的质量相等
【答案】B
【解析】解:A.碳酸根离子的水解程度大于碳酸氢根离子,且CO ![]() 以第一步水解为主,则等浓度的溶液,Na2CO3溶液的碱性较强,故A错误; B.Na2CO3和Ca(OH)2混合后生成CaCO3 , 发生Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,NaHCO3可与澄清石灰水发生Ca(OH)2+NaHCO3═CaCO3↓+NaOH+H2O或Ca(OH)2+2NaHCO3═CaCO3↓+Na2CO3+2H2O,故B正确;
以第一步水解为主,则等浓度的溶液,Na2CO3溶液的碱性较强,故A错误; B.Na2CO3和Ca(OH)2混合后生成CaCO3 , 发生Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,NaHCO3可与澄清石灰水发生Ca(OH)2+NaHCO3═CaCO3↓+NaOH+H2O或Ca(OH)2+2NaHCO3═CaCO3↓+Na2CO3+2H2O,故B正确;
C.碳酸氢钠反应快,碳酸钠与盐酸反应分步进行,则与相同浓度稀盐酸反应的剧烈程度为Na2CO3<NaHCO3 , 故C错误;
D.碳酸氢钠的相对分子质量为84,碳酸钠的相对分子质量为106,等质量时碳酸氢钠的物质的量大,生成二氧化碳多,则等质量的固体与足量盐酸反应放出CO2的质量NaHCO3>Na2CO3 , 故D错误;
故选B.

练习册系列答案
相关题目
【题目】无机化合物可根据其组成和性质进行分类: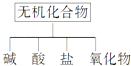
(1)如图所示的物质分类方法名称是 .
(2)以Na、K、H、O、C、S中任意两种或三种元素组成合适的物质,分别填在表②③⑥的后面.
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学式 | ①HCl | ③ | ⑤Na2CO3 | ⑦CO2 |
(3)写出⑦转化为⑤的离子方程式: .
(4)实验室制备⑦常用和反应(写物质的化学式),检验该气体的方法是 .