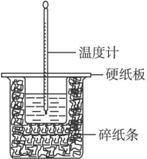
题目内容
用50 mL 0.50 mol · L-1的盐酸与50 mL 0.55 mol · Lf-1的氢氧化钠溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。完成下列问题:
(1)烧杯间填满碎泡沫塑料的作用是__________________;
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?______(填“能”或“不能”),其原因是___________________________________;
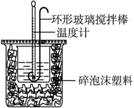
(3)为什么氢氧化钠溶液的浓度要用0.55 mol · L-1?___________________________;
实验中若改用60 mL 0.50 mol · L-1的盐酸与50 mL 0.55 mol · L-1的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”“不相等”),若实验操作均正确,则所求中和热_________(填“相等”“不相等”);
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:_____________________________;
(5)若某同学利用上述装置做实验,有些操作不规范,造成测得的结果偏低,请你分析结果偏低的原因可能是_________(填字母代号)。
a.测量盐酸的温度后,温度计没有用水冲洗干净
b.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
c.做本实验的当天室温较高
d.将50 mL 0.55 mol · L-1的氢氧化钠溶液取成了50 mL 0.55 mol · L-1的氨水
e.在量取盐酸时仰视读数
f.大烧杯的盖板中间小孔太大
(1)减少热量损失
(2)不能 ①铁会和盐酸反应,②铁导热性好,热量损失较大
(3)为了确保盐酸完全被中和 不相等 相等
(4)NaOH(aq) + HCl(aq)==== NaCl(aq) + H2O (l);ΔH=-57.3 kJ· mol-1
(5)abdf
解析:
本题是中学化学新增实验,重点考查学生对中和热测定的实验能力,对出现问题的分析和解决能力,热化学方程式的书写、误差分析等。由于本实验的关键是如何防止热量的损失,所以可以填充大量泡沫、使用玻璃搅拌器、稍过量的氢氧化钠等;(3)中由于参加反应的盐酸(60 mL 0.50 mol · L-1)与氢氧化钠(50 mL 0.55 mol · L-1)完全反应后生成的水的物质的量(50 mL 0.55 mol · L-1)比原先(50 mL ×0.50 mol · L-1)多,所以生成的热量多,但中和热不变;(5)中a.测量盐酸的温度后,温度计没有用水冲洗干净,使参加反应的盐酸的量减小,所测定的热量减少,计算的中和热偏低;b .把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓会造成热量损耗而计算结果减小;c .做本实验的当天室温较高,与所测定的热量无影响;d .将50 mL 0.55 mol · L-1的氢氧化钠溶液取成了50 mL 0.55 mol·L-1的氨水,由于氨水为弱电解质,其电离需吸热,导致反应产生的热量小,中和热减小; e.在量取盐酸时仰视读数,使所取盐酸的体积大于50.0 mL,反应放热大,计算时中和热偏高;f.大烧杯的盖板中间小孔太大,热量损失,中和热低。