题目内容
请根据:Fe+CuSO4=FeSO4+Cu设计成一个原电池.
(1)该电池的负极材料为
(2)正极发生
(3)如果开始的时候两个电极的质量相等,如果过一段时间后两电极的质量相差1.2g,那么该电路中通过的电子的物质的量为
(1)该电池的负极材料为
铁
铁
,其电极反应式为Fe-2e-═Fe2+
Fe-2e-═Fe2+
.(2)正极发生
还原
还原
反应(填“氧化”或“还原”),其电极反应式为Cu2++2e-═Cu
Cu2++2e-═Cu
.(3)如果开始的时候两个电极的质量相等,如果过一段时间后两电极的质量相差1.2g,那么该电路中通过的电子的物质的量为
0.3
0.3
mol.分析:该反应中,铁失电子发生氧化反应而作负极,不如铁活泼的金属或导电的非金属作正极,硫酸铜作电解质溶液,负极上铁失电子发生氧化反应,正极上铜离子得电子发生还原反应,根据正负极上发生的反应进行有关计算.
解答:解:(1)该反应中,铁失电子发生氧化反应而作负极,负极上电极反应式为:Fe-2e-═Fe2+,
故答案为:铁;Fe-2e-═Fe2+;
(2)正极上铜离子得电子发生还原反应,电极反应式为:Cu2++2e-═Cu,故答案为:还原;Cu2++2e-═Cu;
(3)负极上铁失电子进入溶液,正极上铜离子放电析出铜,当转移2mol电子时发生置换反应时两个电极质量差为(64-56)g=8g,如果过一段时间后两电极的质量相差1.2g,那么该电路中通过的电子的物质的量=
×2=0.3mol,故答案为:0.3.
故答案为:铁;Fe-2e-═Fe2+;
(2)正极上铜离子得电子发生还原反应,电极反应式为:Cu2++2e-═Cu,故答案为:还原;Cu2++2e-═Cu;
(3)负极上铁失电子进入溶液,正极上铜离子放电析出铜,当转移2mol电子时发生置换反应时两个电极质量差为(64-56)g=8g,如果过一段时间后两电极的质量相差1.2g,那么该电路中通过的电子的物质的量=
| 1.2g |
| 8g/mol |
点评:本题考查了原电池的设计,原电池的设计关键是负极材料和电解质溶液的成分,一般来说,还原剂作负极,不如负极活泼的金属或非金属导体作正极,氧化剂的溶液作电解质溶液.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目





 6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。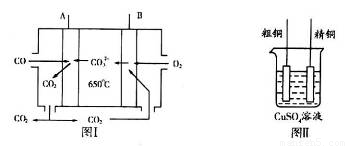
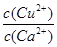 >
>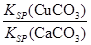 D.
D.


