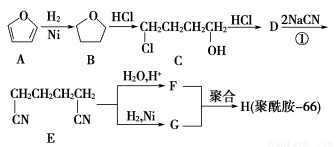
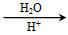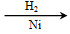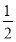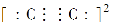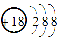题目内容
下列反应的离子方程式表示正确的是( )
A.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑
B.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O
C.小苏打溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32-
D.将足量的铁丝投入稀硝酸中:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
D
【解析】A项,Fe2+和S2-能被硝酸氧化,错误;B项,NH4+还需要和OH-反应生成氨气和水,错误;C项,对于此类离子方程式的书写,应令少量的物质为1 mol,方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O,错误;D项,铁足量,铁先被氧化成Fe3+,然后发生反应:Fe+2Fe3+=3Fe2+,所以最终生成的是Fe2+,正确。

短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。其中Y所处的周期序数与族序数相等。下列说法正确的是( )
|
| X |
|
Y | Z |
| W |
A.原子半径:Y<Z<W
B.气态氢化物的稳定性:X>Z
C.最高价氧化物对应水化物的酸性:Z>W
D.W的最高价氧化物与水反应形成的化合物是离子化合物
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3、MgO、CaO等,生产工艺流程示意如图下:
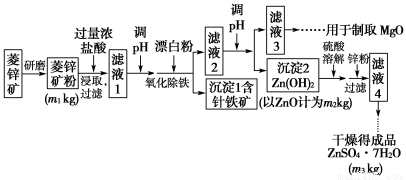
(1)将菱锌矿研磨成粉的目的是____________________________________。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□______+□______=□Fe(OH)3+□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是________________。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为___。
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
开始沉 淀的pH | 10.4 | 6.4 |
|
|
沉淀完全 的pH | 12.4 | 8.0 |
|
|
开始溶 解的pH |
| 10.5 |
|
|
Ksp | 5.6×10-12 |
| 6.8×10-6 | 2.8×10-9 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是________(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为________、________、过滤、洗涤、干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。