题目内容
【题目】下列说法正确的是
A. 已知二元酸H2A在溶液中的电离方程式为:H2A=H++HA- HA-![]() H++A2-,则NaHA溶液中离子浓度的关系有:c(Na+)=c(A2-)+c(HA-)+c(H2A)和c(A2-)=c(H+)- c(OH-)
H++A2-,则NaHA溶液中离子浓度的关系有:c(Na+)=c(A2-)+c(HA-)+c(H2A)和c(A2-)=c(H+)- c(OH-)
B. 已知:室温时Ka(HA)=10-5.则室温时 0.1mol/LNaA溶液的pH约为10
C. HCN溶液加水稀释的过程中c(H+)/c(CN-)减小
D. 向明矾溶液中逐滴滴入Ba(OH)2溶液至硫酸根离子刚好完全沉淀时,所得溶液中离子浓度关系有:c(K+)>c(AlO2-)>c(OH-)>c(H+)
【答案】D
【解析】A.根据二元酸H2A在溶液中的电离方程式为:H2A=H++HA- HA-![]() H++A2-,可知,第一步电离完全电离,第二步部分电离,则NaHA溶液中只存在电离平衡,根据物料守恒有:c(Na+)=c(A2-)+c(HA-),故A错误;B. NaA溶液中存在水解平衡,Kh=
H++A2-,可知,第一步电离完全电离,第二步部分电离,则NaHA溶液中只存在电离平衡,根据物料守恒有:c(Na+)=c(A2-)+c(HA-),故A错误;B. NaA溶液中存在水解平衡,Kh=![]() =10-9=
=10-9= =
=![]() ,c(OH-)=10-5,c(H+)=10-9,溶液的pH约为9,故B错误;C. HCN溶液加水稀释,促进电离,氢离子的物质的量增加的幅度比CN-大,c(H+)/c(CN-)增大,故C错误;D. 向明矾溶液中逐滴滴入Ba(OH)2溶液至硫酸根离子刚好完全沉淀时,所得溶液中含有KAlO2,水解显碱性,离子浓度关系有:c(K+)>c(AlO2-)>c(OH-)>c(H+),故D正确;故选D。
,c(OH-)=10-5,c(H+)=10-9,溶液的pH约为9,故B错误;C. HCN溶液加水稀释,促进电离,氢离子的物质的量增加的幅度比CN-大,c(H+)/c(CN-)增大,故C错误;D. 向明矾溶液中逐滴滴入Ba(OH)2溶液至硫酸根离子刚好完全沉淀时,所得溶液中含有KAlO2,水解显碱性,离子浓度关系有:c(K+)>c(AlO2-)>c(OH-)>c(H+),故D正确;故选D。

 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案【题目】钴(Co)是重要的稀有金属,在工业和科技领域具有广泛的用途。从某含钴工业废料中回收钴的工艺流程如下:
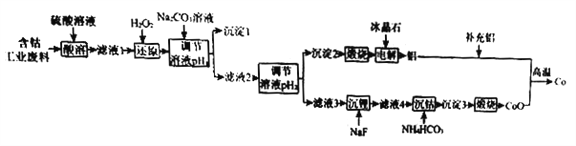
已知:
含钴废料的成分 | |||||
成分 | Al | Li | Co2O3 | Fe2O3 | 其他不溶于强酸的杂质 |
质量分数/% | 10.5 | 0.35 | 65.6 | 9.6 | 13.95 |
Ⅱ.实验中部分离子开始沉淀和沉淀完全的pH | |||
金属离子 | Fe3+ | Co2+ | Al3+ |
开始沉淀的pH | 1.9 | 7.15 | 3.4 |
沉淀完全的pH | 3.2 | 9.15 | 4.7 |
Ⅲ.离子浓度小于等于1.0×10-5 mol·L-1时,认为该离子沉淀完全。
请回答下列问题:
(1)NaF的电子式为____________。
(2)“沉淀1”的化学式为____________________。“调节溶液pH2”的范围为_________________。
(3)“还原”时发生反应的离子方程式为_______________________。
“沉钴”时发生反应的离子方程式为________________________。
(4)制备Co时,“补充铝”的原因为_________________________。
(5)已知:l0-0.9≈0.13,则 A1(OH)3 的溶度积常数 Ksp=_____________________。
(6)Li-SOCl2电池可用于心脏起搏器,该电池的总反应可表示为::4Li+2SOCl2=4LiCl+S+SO2,其正极反应式为_____________

