题目内容
【题目】氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25 ℃时:
①HF(aq)+OH-(aq)===F-(aq)+H2O(l) ![]() H=-67.7 kJ·mol-1
H=-67.7 kJ·mol-1
②H+(aq)+OH-(aq)===H2O(l) ![]() H=-57.3 kJ·mol-1
H=-57.3 kJ·mol-1
在20 mL 0.1 mol·L-1氢氟酸中加入V mL 0.1 mol·L-1 NaOH溶液,下列有关说法正确的是( )
A.氢氟酸的电离方程式及热效应可表示为:HF(aq)![]() F-(aq)+H+(aq)
F-(aq)+H+(aq) ![]() H=+10.4 kJ·mol-1
H=+10.4 kJ·mol-1
B.当V=20时,溶液中:c(OH-)=c(HF)+c(H+)
C.当V=20时,溶液中:c(F-)<c(Na+)=0.1 mol·L-1
D.当V>0时,溶液中一定存在:c(Na+)>c(F-)>c(OH-)>c(H+)
【答案】B
【解析】
试题分析:1式—2式即可得到氟化氢电离的方程式,![]() H=-10.4 kJ·mol-1故A错
H=-10.4 kJ·mol-1故A错
B.当V=20时,由于氢氟酸是弱酸,所以混合后溶液呈碱性,根据质子守恒可得c(OH-)=c(HF)+c(H+),故对。
C.当V=20时,由于混合液的体积加倍,所以物质的量的浓度降低一半,c(F-)<c(Na+)=0.05molL-1故错
D.当V>0时,若V=1时,由于钠离子的物质的量远远小于氟离子,所以溶液中一定不会存在:c(Na+)>c(F-)>c(OH-)>c(H+),故错

【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 ,盛装标准盐酸的仪器名称为 ;滴定至终点的颜色变化为 。
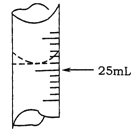
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。
(3)乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 1.00 | 27.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字)。
(4)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数