题目内容
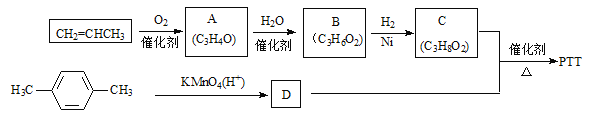
【题目】石棉尾矿主要含有Mg3(Si2O5)(OH)4和少量的Fe2O3、Al2O3。以石棉尾矿为供源制备碳酸镁晶须(MgCO3·nH2O)的工艺如下:

已知“焙烧”过程中的主反应为:
Mg3(Si2O5)(OH)4+5(NH4)2SO4![]() 3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
(1)写出焙烧产物NH3的电子式__________。
(2)为提高水浸速率,可采取的措施为_________(任写一条)。“浸渣”的主要成分为________。
(3)“除铁、铝”时,需将pH调至8.0左右,适宜作调节剂的是_________(填字母代号)。
a. NaOH b.Ca(OH)2 c.NH3·H2O
(4)“沉镁”过程中反应的离子方程式为________________。
(5)流程中可以循环利用的物质是________(填化学式)。
【答案】 ![]() 将焙烧渣粉碎或加热或搅拌 SiO2 c Mg2++2HCO3-+(n-1)H2O=MgCO3·nH2O↓+CO2↑ (NH4)2SO4
将焙烧渣粉碎或加热或搅拌 SiO2 c Mg2++2HCO3-+(n-1)H2O=MgCO3·nH2O↓+CO2↑ (NH4)2SO4
【解析】本题是一道工艺流程题,要求看懂反应的原理和流程,弄清每一步反应中的反应原理和操作要点,每一步反应得到的产物及其所含的杂质,根据所学的化学原理和基本实验操作,即可作答。
石棉尾矿焙烧得到产物MgSO4和杂质SiO2、及含Al、Fe的硫酸盐,水浸后过滤分离除去不溶物SiO2,向滤液中加入氨水调节pH至8.0左右,使Al、Fe的可溶盐转化为沉淀而除去,最后加入NH4HCO3,将Mg2+转化为MgCO3沉淀。
(1)氨气的电子式为:![]()
(2)为提高水浸速率,可以将原料粉碎增大其与水的接触面、可以加热升高温度、可以在氺浸的过程中不断搅拌、或者将水以喷雾的形式与原料混合等等。答案为:将焙烧渣粉碎或加热或搅拌 (合理即可);SiO2不溶于水,故答案为:滤渣为SiO2
(3)除铁、铝”时,将pH调至8.0左右,必须加入碱性溶液,且碱性不能太强,防止Al的可溶性化合物又转化为其他Al的可溶性化合物,且不能带入新的杂质,所以不能用NaOH和Ca(OH)2,故只能选用氨水,答案为:c
(4)加入NH4HCO3时Mg2+转化为MgCO3·nH2O沉淀,两个HCO3-失去两个H+,得到两个CO32-,一个 CO32-与Mg 2+结合,一个CO32-与两个H+结合生成CO2,离子方程式为:Mg2++2HCO3-+(n-1)H2O=MgCO3·nH2O↓+CO2↑
(5)在沉镁的过程中,除了生成MgCO3·nH2O沉淀外,还有(NH4)2SO4生成,第一步焙烧中也需要(NH4)2SO4,故可以循环利用的物质是(NH4)2SO4。

【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
序号 | 反应温度/℃ | C(H2O2)/mol-L | V(H2O2)/mL | M(MnO2)/g | t/min |
1 | 20 | 2 | 10 | 0 | t1 |
2 | 20 | 2 | 10 | 0.1 | t2 |
3 | 20 | 4 | 10 | 0.1 | t3 |
4 | 40 | 2 | 10 | 0.1 | t4 |
(1)设计实验2和实验3的目的是研究_______对化学反应速率的影响。
(2)为研究温度对化学反应速率的影响,可以将实验_____和实验____作对比(填序号)。
(3)将实验1和实验2作对比,t1____t2(填“>”、“<”或“=”)。
II.以KI和FeCl3反应为例(2Fe3++2I-![]() 2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:①0.1mol·L-1KI溶液 ②0.1mol·L-1 FeCl3溶液③0.1mol·L-1 FeCl2溶液 ④0.1mol·L-1 HCl溶液⑤0.1mol·L-1 FeSCN溶液⑥ CCl4
2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:①0.1mol·L-1KI溶液 ②0.1mol·L-1 FeCl3溶液③0.1mol·L-1 FeCl2溶液 ④0.1mol·L-1 HCl溶液⑤0.1mol·L-1 FeSCN溶液⑥ CCl4
实验步骤:
(1)取5mL0.1mol·L-1KI溶液,再滴加几滴0.1mol·L-1 FeCl3溶液
(2)充分反应后,将溶液分成三份;
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
(4)另取一份,加试剂_______(填序号),现象___________,说明此反应存在一定的限度。