题目内容
10.用下列实验装置进行相应实验,能达到实验目的是( )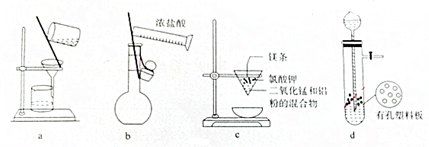
| A. | 用图a所示装置除去淀粉溶液中的NaCl | |
| B. | 用图b所示装置配制100mL 0.100mo•L-1稀盐酸 | |
| C. | 图c所示装置可用于制取金属锰 | |
| D. | 图d所示装置可用于Cu和浓H2SO4制取少量的SO2气体 |
分析 A.氯化钠和淀粉都能够通过滤纸,不能通过过滤的操作方法分离;
B.稀释浓盐酸应该在烧杯中进行;
C.铝的还原性大于锰,可以用铝热反应获得金属锰;
D.浓硫酸和铜应在加热条件下进行.
解答 解:A.淀粉和NaCl都能够透过滤纸,通过过滤操作无法除去NaCl,故A错误;
B.稀释浓盐酸应该在烧杯中进行,不能在容量瓶中稀释浓盐酸,故B错误;
C.金属铝比锰活泼,可用铝热法制备锰,故C正确;
D.浓硫酸和铜应在加热条件下进行,该装置不能制备二氧化硫气体,故D错误;
故选C.
点评 本题考查较为综合,涉及化学实验基本操作方法判断、物质性质及其应用等知识,题目难度中等,试题综合考查学生的分析能力、实验能力和评价能力,为高考常见题型,注意把握物质的性质的异同以及实验的严密性和可行性的评价.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
20.X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子的价电子排布式为ns1,且原子半径是同族元素最小的.
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布式中,p轨道上只有1个未成对电子.
③Z元素的电离能(用符号I表示)数据见表(kJ•mol-1)
请回答:
(1)Z2Y中含有的化学键类型为离子键.
(2)Z2Y2的电子式为 .
.
(3)X2Y分子的空间构型为V形,其中心原子的杂化方式为sp3,XWY属于极性(填“极性”或“非极性”)分子.
①X元素原子的价电子排布式为ns1,且原子半径是同族元素最小的.
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布式中,p轨道上只有1个未成对电子.
③Z元素的电离能(用符号I表示)数据见表(kJ•mol-1)
| I1 | I2 | I3 | I4 | … |
| 496 | 4 562 | 6 912 | 9 540 | … |
(1)Z2Y中含有的化学键类型为离子键.
(2)Z2Y2的电子式为
 .
.(3)X2Y分子的空间构型为V形,其中心原子的杂化方式为sp3,XWY属于极性(填“极性”或“非极性”)分子.
1.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 60g丙醇中存在的共价键总数为10NA | |
| C. | 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA | |
| D. | 1L 0.1mol•L-1的NaHCO3-溶液中HCO3-和CO32-离子数之和为0.1NA |
18.下列说法正确的是( )
| A. | 蛋白质、油脂都是高分子化合物 | B. | 米汤遇碘盐会变蓝 | ||
| C. | 硅胶可用作食品干燥剂 | D. | 可以用烧碱清除炊具上残留的油污 |
5.(1)相同体积、相同物质的量浓度的AgNO3溶液,分别与相同体积的KCl、CuCl2、AlCl3溶液反应恰好完全反应,则KCl、CuCl2、AlCl3三种溶液的物质的量浓度之为6:3:2.
(2)M(NO3)2热分解化学方程式为2M(NO3)2═2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集11.2L的气体,那么M的摩尔质量是40g/mol.
(3)现有一种铜和氧化亚铁的混合物样品.为测定该样品中氧化亚铁的含量,某学生
取20.0g此样品置于烧杯中,分四次加入密度为1.22g/cm3的硫酸并作相关记录.有关数据记录如下表:
试计算:①10.0g此样品中铜的物质的量0.0625mol.②样品中氧化亚铁的质量分数60%.③所用硫酸溶液溶质的物质的是浓度2.8mol/l.
(4)液态CS2能够在O2中燃烧生成CO2和SO2两种气体,今用0.228g CS2在448mL氧气(标准状况)中完全燃烧,反应后混合气体的平均摩尔质量是43.4g/mol.
(2)M(NO3)2热分解化学方程式为2M(NO3)2═2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集11.2L的气体,那么M的摩尔质量是40g/mol.
(3)现有一种铜和氧化亚铁的混合物样品.为测定该样品中氧化亚铁的含量,某学生
取20.0g此样品置于烧杯中,分四次加入密度为1.22g/cm3的硫酸并作相关记录.有关数据记录如下表:
| 加硫酸的序号 | 加硫酸的体积/mL | 剩余固体的质量/g |
| 1 | 20.0 | 16.0 |
| 2 | 20.0 | 12.0 |
| 3 | 20.0 | 8.0 |
| 4 | 20.0 | 8.0 |
(4)液态CS2能够在O2中燃烧生成CO2和SO2两种气体,今用0.228g CS2在448mL氧气(标准状况)中完全燃烧,反应后混合气体的平均摩尔质量是43.4g/mol.
15.下列关于物质用途的说法中,不正确的是( )
| A. | 氨可用作制冷剂 | B. | 氧化铝可用作耐火材料 | ||
| C. | 晶体硅可用于制造光导纤维 | D. | Fe2O3可以做油漆的颜料 |
2.下列说法正确的是( )
| A. | 电离时生成的阳离子全部是氢离子的化合物叫做酸 | |
| B. | CO2的水溶液可以导电,所以CO2是电解质 | |
| C. | 所有盐均电离出金属阳离子和酸根离子 | |
| D. | 强电解质的溶液导电能力强于弱电解质的溶液 |
19.下列说法不正确的是( )
| A. | 乙烯是石油裂解后的产物 | |
| B. | 天然气是重要的化工原料 | |
| C. | 石油的分馏可以得到汽油、煤油、柴油 | |
| D. | 芳香烃主要来自于煤的干馏后的煤焦油 |
20. 如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许Na+通过.已知电池充、放电的化学方程式为2Na2S2+NaBr3 $?_{充电}^{放电}$Na2S4+3NaBr.当闭合开关K时,X极附近溶液先变红色.下列说法中正确的是( )
如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许Na+通过.已知电池充、放电的化学方程式为2Na2S2+NaBr3 $?_{充电}^{放电}$Na2S4+3NaBr.当闭合开关K时,X极附近溶液先变红色.下列说法中正确的是( )
 如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许Na+通过.已知电池充、放电的化学方程式为2Na2S2+NaBr3 $?_{充电}^{放电}$Na2S4+3NaBr.当闭合开关K时,X极附近溶液先变红色.下列说法中正确的是( )
如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许Na+通过.已知电池充、放电的化学方程式为2Na2S2+NaBr3 $?_{充电}^{放电}$Na2S4+3NaBr.当闭合开关K时,X极附近溶液先变红色.下列说法中正确的是( )| A. | 闭合K时,装置(Ⅰ)中Na+从右到左通过离子交换膜 | |
| B. | 闭合K时,A电极的电极反应式为NaBr3+2Na++2e-═3NaBr | |
| C. | 闭合K时,X电极的电极反应式为2Cl--2e-═Cl2↑ | |
| D. | 闭合K时,当有0.1 mol Na+通过离子交换膜,则X电极上析出气体在标准状况下的体积为1.12 L |