题目内容
【题目】(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是:_________________。
(2)Li﹣SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4﹣SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2↑.请回答下列问题:
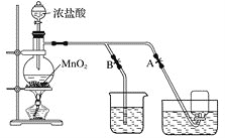
①SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成.如果把少量水滴到SOCl2中,反应的化学方程式为______。
②组装该电池必须在无水、无氧的条件下进行,原因是______。
(3)如下图是一个电化学过程示意图
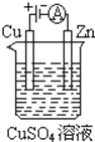
①锌片上发生的电极反应是______。
②假设使用Li﹣SOCl2电池作为本过程中的电源,铜片的质量变化为128g,则Li﹣SOCl2电池理论上消耗Li的质量______g。
【答案】N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624kJ/mol SOCl2+H2O=SO2↑+2HCl↑ 锂是活泼金属,易与H2O、O2反应;SOCl2也可与水反应 Cu2++2e-=Cu 28g
【解析】
(1)根据肼和反应热的关系计算出其燃烧热,并写出其相应的热化学方程式;
(2)①根据SOCl2与NaOH溶液反应的生成物确定SOCl2与水反应的生成物,根据与水反应生成物的性质判断反应现象,从而写出与水反应的方程式;
②根据类比钠的活泼性判断锂的活泼性,根据锂的活泼性以及SOCl2的性质分析;
(3)①锌片连接电源的负极,作阴极,发生还原反应;
②根据同一闭合回路中转移电子数目相等,分析解答。
(1)32.0g肼的物质的量为n(N2H4)=32.0g÷32g/mol=1mol,1molN2H4在氧气中完全燃烧生成氮气放出热量624kJ,所以其热化学反应方程式为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624kJ/mol;
(2)①根据NaOH和SOCl2生成Na2SO3和NaCl两种盐可知:SOCl2和水生成酸或酸性氧化物,根据原子守恒得,SOCl2和水生成SO2和HCl,反应方程式为为:SOCl2+H2O=SO2↑+2HCl↑;
②由于锂和钠是同一主族的元素,二者化学性质具有相似性,钠和空气中的氧气、水蒸气反应,因此锂和空气中的氧气、水蒸气也能反应;且SOCl2也可与水反应,所以组装该电池必须在无水、无氧的条件下进行;
(3)①根据装置图可知:锌片与外接电源的负极连接,作阴极,发生还原反应,电极反应式为:Cu2++2e-=Cu;
②铜片连接电源的正极,作阳极,发生氧化反应,Cu是+2价的金属,铜片质量变化128g,转移电子的物质的量n(e-)=![]() ×2=4mol,Li是+1价的金属,所以反应消耗Li的质量质量为m(Li)=4mol×7g/mol=28g。
×2=4mol,Li是+1价的金属,所以反应消耗Li的质量质量为m(Li)=4mol×7g/mol=28g。

【题目】在稀氨水中存在下述电离平衡NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
加入的物质 | 少量(NH4)2SO4固体 | 少量HNO3溶液 | 少量KOH溶液 |
c(OH-)的变化 | |||
平衡移动方向 |