题目内容
16.a、b、c、d为短周期元素,a的最外层电子数为内层电子数的2倍,b的最高化合价为最低化合价绝对值的3倍,b与c同周期,c的原子半径小于b,d的M电子层有1个电子,下列叙述错误的是( )| A. | c元素的非金属性最强 | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | 只有d与其他元素生成的化合物都是离子化合物 | |
| D. | a、b、c与氢形成的化合物中化学键均为极性共价键 |
分析 a的最外层电子数为内层电子数的2倍,则a为C元素,b的最高化合价为最低化合价绝对值的3倍,则最低价为-2价,最高正价为+6价,所以b为S元素,b与c同周期,c的原子半径小于b,则c为Cl元素d的M电子层有1个电子,c应为Na元素,结合对应单质、化合物的性质以及元素周期率知识解答该题.
解答 解:a的最外层电子数为内层电子数的2倍,则a为C元素,b的最高化合价为最低化合价绝对值的3倍,则最低价为-2价,最高正价为+6价,所以b为S元素,b与c同周期,c的原子半径小于b,则c为Cl元素,d的M电子层有1个电子,d应为Na元素,
A.C、Na、S、Cl中元素的非金属性最强的是Cl,即c元素的非金属性最强,故A正确;
B.四种元素形成的氧化物有CO、CO2;Na2O、Na2O2;SO2、SO3,而Cl的化合价有多种,则氧化物也有多种,如ClO2、Cl2O等,故B正确;
C.d为Na,为金属,可与其他元素生成离子化合物,含有离子键,故C正确;
D.C、S、Cl中,C可与氢气反应生成C2H2、C2H4、C2H6等化合物,含有同种元素形成的共价键,为非极性键,故D错误.
故选D.
点评 本题涉及原子结构与元素周期率的考查,侧重于学生的分析能力的培养和原子结构、元素周期率的综合应用的考查,注意把握提给信息以及元素周期率的递变规律,难度不大.

练习册系列答案
相关题目
6.下列反应中生成物总能量高于反应物总能量的是( )
| A. | NH4Cl晶体受热分解 | B. | 木炭燃烧 | ||
| C. | 钠与水反应 | D. | 酸碱中和反应 |
7.通过书写化学方程式举出反例,证明下列说法不正确.
| 氧化反应一定属于化合反应 | CH4+2O2 $\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O |
| 生成盐和水的反应一定是中和反应 | Ca(OH)2+CO2═CaCO3↓+H2O |
| 只有在加热或高温条件下才能冶炼出金属 | Fe+CuSO4═FeSO4+Cu |
4.目前科学家提出了一种最经济最理想的获得氢能源的循环体系(如图).下列说法错误的是( )
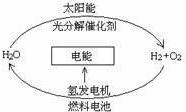

| A. | 在此循环中发生了反应:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | |
| B. | 燃料电池是将化学能转化为电能的装置 | |
| C. | 该氢能源的循环体系能够实现太阳能转化为电能 | |
| D. | 目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂 |
11.下列叙述不正确的是( )
| A. | 天然气和沼气的主要成分是甲烷 | |
| B. | 所有糖类物质都有甜味 | |
| C. | 纤维素乙酸酯、油脂和蛋白质在一定条件下都能水解 | |
| D. | 葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物 |
1.下列属于天然高分子化合物的组合是( )
| A. | 天然橡胶、淀粉 | B. | 油脂、蛋白质 | C. | 塑料、纤维素 | D. | 蔗糖、淀粉 |
8.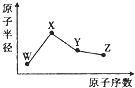 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图所示.已知W的一种核素的质量数为18,中子数为10;X是短周期元素中原子半径最大的;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图所示.已知W的一种核素的质量数为18,中子数为10;X是短周期元素中原子半径最大的;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图所示.已知W的一种核素的质量数为18,中子数为10;X是短周期元素中原子半径最大的;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图所示.已知W的一种核素的质量数为18,中子数为10;X是短周期元素中原子半径最大的;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )| A. | 简单离子半径:W>X>Z | |
| B. | 最简单气态氢化物的稳定性:Y<Z | |
| C. | 化合物XZW中既含离子键又含共价键 | |
| D. | Y的氧化物能与X的最高价氧化物对应的水化物反应 |
5.下列有关实验操作正确的是( )
| A. | 蒸馏实验中温度计的水银球应插入液态混合物中 | |
| B. | 用酒精萃取碘水中的碘 | |
| C. | 分液时,打开旋塞,使下层液体从下口流出,上层液体从上口倒出 | |
| D. | 开始蒸馏时,应该先加热,再开冷凝水;蒸馏完毕,应先关冷凝水再撤酒精灯 |
18.已知反应:A(g)+B(g)?C(g)+D(g)的平衡常数与温度的关系如下表.830℃时,向一个2L的密闭容器中充入0.2mol A和0.8mol B,反应至4s时c(C)=0.02mol/L.下列说法正确的是( )
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数K=0.4 | |
| B. | 反应达平衡后,升高温度,平衡正向移动 | |
| C. | 4s内,用A表示的该反应的平均反应速率v(A)=0.01mol/(L•s) | |
| D. | 830℃下反应达平衡时,B的转化率为20% |