题目内容
12.取物质的量浓度为10mol/L的硫酸加水稀释,得到0.5mol/L的硫酸0.2L,求需要10mol/L的硫酸为( )| A. | 10mL | B. | 20mL | C. | 50mL | D. | 100mL |
分析 根据稀释定律,稀释前后溶质硫酸的物质的量不变,据此计算.
解答 解:设需要10mol/L的硫酸的体积为V,根据稀释定律,稀释前后溶质硫酸的物质的量不变,则:
V×10mol/L=0.5mol/L×2L
解得V=0.1L
即需要需要10mol/L的硫酸体积为100mL,
故选D.
点评 本题考查物质的量浓度有关计算,比较基础,注意对公式的理解与灵活应用.

练习册系列答案
相关题目
3.某原电池装置如图所示.下列说法正确的是( )


| A. | 石墨棒为负极 | B. | 工作时电能转化为化学能 | ||
| C. | 锌片的质量减少 | D. | 电子从石墨棒流向铁片 |
20.可逆反应:A(g)+2B(g)═2C(g)△H=-Q kJ/mol.现有甲、乙两个容积相等且不变的密闭容器,向甲容器中充入1mol A和2mol B,在一定条件下达到平衡时放出的热量为Q1 kJ;在相同条件下向乙容器中充入2mol C,达到平衡后吸收的热量为Q2 kJ.已知Q1=9Q2,下列叙述中正确的是( )
| A. | Q1=Q | B. | 平衡时甲中C的体积分数比乙中小 | ||
| C. | 达到平衡时,甲中A的转化率为90% | D. | Q1+Q2>Q |
7.蒸馏原理主要依据各成分的哪种性质不同( )
| A. | 状态 | B. | 凝固点 | C. | 沸点 | D. | 溶解度 |
4.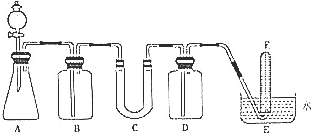 在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品、用图中的实验装置进行实验,证明过氧化钠可作供氧剂.
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品、用图中的实验装置进行实验,证明过氧化钠可作供氧剂.
(1)填写表中空格:
(2)在上述某一装置中,11.6g CO2和水蒸气的混合气体与足量的Na2O2充分反应后,固体质量增加了3.6g,则原混合气体的平均相对分子质量为23.2
A.5.8 B.11.6 C.23.2 D.46.4
(3)试管F收集满气体后,下一步实验操作是把F中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气
(4)某人按下列方程测定样品中Na2O2的含量:称取一定量样品溶于足量的水,发生反应:Na2O2+2H2O=2NaOH+H2O2,2H2O2$\frac{\underline{\;NaOH\;}}{\;}$2H2O+O2↑,根据生成O2的量计算样品中Na2O2的纯度,他仔细实验过多次,得到的Na2O2含量均明显低于实际含量,这是因为B.
A.称量错误
B.H2O2分解不完全
C.Na2O2转化为H2O2和NaOH的反应不完全
D.装置漏气.
 在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品、用图中的实验装置进行实验,证明过氧化钠可作供氧剂.
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品、用图中的实验装置进行实验,证明过氧化钠可作供氧剂.(1)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | 除去CO2气体中混入的HCl |
| C | 石棉绒与过氧化钠 | 与CO2和水气反应,产生O2 |
| D | NaOH | 吸收未反应的CO2气体 |
A.5.8 B.11.6 C.23.2 D.46.4
(3)试管F收集满气体后,下一步实验操作是把F中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气
(4)某人按下列方程测定样品中Na2O2的含量:称取一定量样品溶于足量的水,发生反应:Na2O2+2H2O=2NaOH+H2O2,2H2O2$\frac{\underline{\;NaOH\;}}{\;}$2H2O+O2↑,根据生成O2的量计算样品中Na2O2的纯度,他仔细实验过多次,得到的Na2O2含量均明显低于实际含量,这是因为B.
A.称量错误
B.H2O2分解不完全
C.Na2O2转化为H2O2和NaOH的反应不完全
D.装置漏气.
1.实验室收集下列各组气体,选用相同方法的一组是( )
| A. | H2和HCl | B. | CO2和H2 | C. | CO2和HCl | D. | CO2和NH3 |