题目内容
氨气是重要化工产品之一.传统的工业合成氨技术的反应原理是:N2(g)+3H2(g)
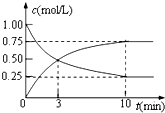
2NH3(g)△H=-92.4kJ/mol.在500℃、20MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量浓度变化如图1所示,回答下列问题:

(1)计算反应在第一次平衡时的平衡常数K= .(保留二位小数)
(2)产物NH3在5~10min、25~30min和45~50min时平均反应速率(平均反应速率分别以v1、v2、v3表示)从大到小排列次序为 .
(3)H2在三次平衡阶段的平衡转化率分别以α1、α2、α3表示,其中最小的是 .
(4)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 .
(5)请在图2中用实线表示25~60min各阶段化学平衡常数K的变化图象.
| 催化剂 |
| 高温高压 |

(1)计算反应在第一次平衡时的平衡常数K=
(2)产物NH3在5~10min、25~30min和45~50min时平均反应速率(平均反应速率分别以v1、v2、v3表示)从大到小排列次序为
(3)H2在三次平衡阶段的平衡转化率分别以α1、α2、α3表示,其中最小的是
(4)由第一次平衡到第二次平衡,平衡移动的方向是
(5)请在图2中用实线表示25~60min各阶段化学平衡常数K的变化图象.
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)①根据图示数据得出第一次达到平衡时反应物和生成物浓度,再根据平衡常数的表达式计算出第一次平衡时平衡常数K;
(2)根据反应速率的表达式:v=
,时间变化都是5min,根据浓度变化判断v1、v2、v3;
(3)根据表中达到平衡状态时氢气的浓度计算出氢气的转化率,然后判断H2在三次平衡阶段的平衡转化率大小;
(4)25min时氨气的浓度为0、氢气和氮气的浓度逐渐减小,据此进行分析改变的条件;
(5)根据影响平衡常数的外界因素可以画出平衡常数的变化图象;
(2)根据反应速率的表达式:v=
| △c |
| △t |
(3)根据表中达到平衡状态时氢气的浓度计算出氢气的转化率,然后判断H2在三次平衡阶段的平衡转化率大小;
(4)25min时氨气的浓度为0、氢气和氮气的浓度逐渐减小,据此进行分析改变的条件;
(5)根据影响平衡常数的外界因素可以画出平衡常数的变化图象;
解答:
解:(1)第一次达到平衡常数时,氨气的浓度为:2.00mol/L,氢气浓度为:3.00mol/L,氮气的浓度为:1.00mol/L,
第一次平衡时平衡常数K=
≈0.15,
故答案为:0.15;
(2)由图可知,5~10min氨气的浓度变化大于0.5mol/L,25~30min氨气浓度变化约为0.5mol/L,45~50min氨气的浓度变化为(1.0-0.76)mol/L=0.24mol/L,时间变化为5min,由v=
可知,反应速率关系为:v1>v2>v3,
故答案为:v1>v3>v2;
(3)第一次平衡时氢气的转化率为:
×100%=50%,第二次平衡时氢气的转化率为:
×100%=38%,第三次达到平衡时氢气的转化率为:
×100%≈19.4%,显然第三次氢气的转化率最低,即最小的是α3,
故答案为:α3;
(4)25min时生成物氨气的物质的量浓度为0、氮气和氢气的浓度逐渐减小,说明从反应体系中移出产物氨气,平衡向着正向移动;
故答案为:正反应方向移动,移走生成物NH3;
(5)25min时生成物氨气的物质的量浓度为0、氮气和氢气的浓度逐渐减小,说明从反应体系中移出产物氨气,平衡常数不变,45min时,氨气的浓度增大,氮气、氢气的浓度减小,化学平衡平衡向着正向移动,该反应是放热反应,说明降低了温度,平衡常数变大,据此可以画图为: ;
;
故答案为: ;
;
第一次平衡时平衡常数K=
| 2.002 |
| 1.00×3.002 |
故答案为:0.15;
(2)由图可知,5~10min氨气的浓度变化大于0.5mol/L,25~30min氨气浓度变化约为0.5mol/L,45~50min氨气的浓度变化为(1.0-0.76)mol/L=0.24mol/L,时间变化为5min,由v=
| △c |
| △t |
故答案为:v1>v3>v2;
(3)第一次平衡时氢气的转化率为:
| 6.0-3.0 |
| 6.0 |
| 3.00-1.86 |
| 3.00 |
| 1.86-1.50 |
| 1.86 |
故答案为:α3;
(4)25min时生成物氨气的物质的量浓度为0、氮气和氢气的浓度逐渐减小,说明从反应体系中移出产物氨气,平衡向着正向移动;
故答案为:正反应方向移动,移走生成物NH3;
(5)25min时生成物氨气的物质的量浓度为0、氮气和氢气的浓度逐渐减小,说明从反应体系中移出产物氨气,平衡常数不变,45min时,氨气的浓度增大,氮气、氢气的浓度减小,化学平衡平衡向着正向移动,该反应是放热反应,说明降低了温度,平衡常数变大,据此可以画图为:
 ;
;故答案为:
 ;
;
点评:本题考查了化学平衡的计算、化学平衡常数的计算、影响化学平衡的因素、物质的量浓度变化随时间变化的曲线,题目难度中等,注意掌握影响化学平衡的因素、化学平衡常数的表达式、化学平衡的计算中差量法的应用,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
100mL 0.1mol/L的下列溶液中,阴离子总数多少的排列顺序正确的是( )
①CaCl2 ②CH3COONa ③NaCl ④Na2CO3.
①CaCl2 ②CH3COONa ③NaCl ④Na2CO3.
| A、①>④>③>② |
| B、①>④>③=② |
| C、①>④=③=② |
| D、①>④>②>③ |
 为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.(相对原子质量 C-12 H-1 O-16)
为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.(相对原子质量 C-12 H-1 O-16)