题目内容
向100ml0.1 mol·L-1的Al2(SO4)3溶液中,加入0.5mol·L-1的氢氧化钠溶液得到1.17克沉淀,则需加入的氢氧化钠溶液的体积是多少?(强调要有解题过程)
90ml 或 130ml
试题分析:假设:1、氢氧化钠不足量,氢氧根全部转化为沉淀。
设 KOH溶液的体积是xL,
3OH-+Al3+=Al(OH)3↓
3mol 78g
0.5xmol 1.17g
x=0.09L,即90ml。
2、硫酸铝不足量,先生成沉淀,后沉淀部分溶解.
硫酸铝中Al3+的物质的量为2×0.1mol/L×0.1L=0.02mol,1.17g沉淀需要Al3+的物质的量为1.17g/78(g/mol) =0.015mol
转变成AlO2-的Al3+的物质的量为0.005mol.
设KOH溶液的体积是yL,
3OH-+Al3+=Al(OH)3↓
3 mol 78g
0.045mol 1.17g
4OH-+Al3+=AlO2-+2H2O
4mol 1mol
0.02mol 0.005mol
所以KOH溶液的体积是V=n/c=(0.045mol+0.02mol)/ 0.5(mol·L-1) =0.13L,即130ml。
故答案为:90ml 或 130ml。
点评:本题考查的是物质的量浓度的相关计算,侧重考查学生全面分析问题的能力,因氢氧化铝的两性,要注意考虑沉淀先生成后溶解现象,防止答案遗漏。

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
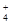 、Cl- 、NO
、Cl- 、NO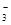
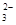 、Na+、S2-
、Na+、S2-