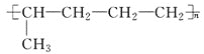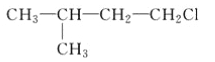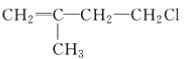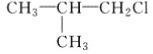题目内容
【题目】短周期主族元素A、B、C、D、E的原子序数依次增大,其中A、D同主族,B、C、D、E同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素,C原子的质子数比B原子的质子数多2个。请回答下列问题:
(1)B元素的名称为___________,D的元素符号为___________,E的离子结构示意图为___________。
(2)D、E两种元素可形成化学式为DE2、D2E2等化合物,则DE2的电子式为___________________,D2E2的结构式为___________(请填写具体物质的化学式)。
(3)将B2A2投入到B2D的水溶液中可生成D的单质,发生反应的离子方程式为:______________________,请用单线桥标出此反应中电子转移的方向和数目。
(4)DA2与E元素的单质在水中反应的离子方程式为:_________________________________。
(5)向由C、E两种元素组成的化合物溶液400mL1 mol/L中加入500mL—定物质的量浓度的KOH溶液,得到白色沉淀15.6 g,则KOH溶液的物质的量浓度为___________mol/L或___________mol/L。
【答案】钠 S 
![]() Cl—S—S—Cl
Cl—S—S—Cl  SO2+Cl2+2H2O=4H++2Cl-+SO42- 1.2 2.8
SO2+Cl2+2H2O=4H++2Cl-+SO42- 1.2 2.8
【解析】
短周期主族元素A、B、C、D、E的原子序数依次增大,A原子的最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故A为O元素;A、D同主族,则D为S元素;E的原子序数最大,故E为Cl;B是短周期元素中原子半径最大的主族元素,则B为Na;C原子的质子数比B原子的质子数多2个,则C为Al,据此解答。
(1)由上述分析可以知道,B元素的名称为:钠,D的元素符号为:S,E的离子为Cl-,离子结构示意图为 ,
,
因此,本题正确答案是:钠;S; ;
;
(2)SCl2分子中S原子与Cl之间形成1对共用电子对,电子式为![]() ,S2Cl2分子中S原子之间形成1对共用电子对,S原子与Cl原子之间形成1对共用电子对,结构式为Cl—S—S—Cl;
,S2Cl2分子中S原子之间形成1对共用电子对,S原子与Cl原子之间形成1对共用电子对,结构式为Cl—S—S—Cl;
因此,本题正确答案是:![]() ;Cl—S—S—Cl;
;Cl—S—S—Cl;
(3) Na2O2和Na2S的水溶液发生氧化还原反应生成硫的单质,根据得失电子守恒和电荷守恒,反应的离子方程式为:Na2O2+S2-+2H2O=S+2Na++4OH-;过氧化钠得电子,S2-失电子,则用单线桥标出此反应中电子转移的方向和数目为: ,
,
因此,本题正确答案是: ;
;
(4)SO2与氯气在水中反应生成HCl与硫酸,反应的离子方程式为:SO2+Cl2+2H2O=4H++2Cl-+SO42-,
因此,本题正确答案是:SO2+Cl2+2H2O=4H++2Cl-+SO42-;
(5)向由C、E两种元素组成的化合物为AlCl3,其物质的量为0.2L×2mol/L=0.4mol,如完全生成沉淀,则应生成0.4molAl(OH)3,实际得到白色沉淀15.6g,物质的量为![]() =0.2mol<0.4mol,说明Al3+没有完全生成沉淀,可能存在两种情况:
=0.2mol<0.4mol,说明Al3+没有完全生成沉淀,可能存在两种情况:
①NaOH不足,铝离子部分转化氢氧化铝沉淀,则:
Al3++3OH-=Al(OH)3↓,
0.6mol 0.2mol
此时c(NaOH)=![]() =1.2mol/L,
=1.2mol/L,
②NaOH部分过量,铝离子转化为氢氧化铝沉淀、偏铝酸根,则:
Al3++3OH-=Al(OH)3↓
0.4mol 1.2mol 0.4mol
溶解的氢氧化铝为0.4mol-0.2mol=0.2mol
Al(OH)3+OH-=AlO2-+2H2O,
0.2mol 0.2mol
则c(NaOH)=![]() =2.8mol/L,
=2.8mol/L,
因此,本题正确答案是:1.2;2.8。

【题目】下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白(填写序号不得分):
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:__________。(填元素符号)
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是__________,碱性最强的化合物的化学式是__________________。
(3)比较①与⑤的最高价氧化物对应的水化物,________________的酸性强(填化学式)
(4)工业上制取②的氢化物的化学方程式_______________________________________;
②的氢化物与②的最高价氧化物的水化物反应所得的产物化学式为_____________。
(5)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因________________________________________________(用化学方程式表示)
(6)比较③与⑥的氢化物,_______________更稳定,__________沸点更高(填化学式)
(7)写出④的单质与水反应的化学方程式_________________________________________。
(8)写出⑦元素的离子结构示意图______________________,该离子半径_________S2-(填“﹥”或“﹤”)写出⑩元素在周期表的位置__________________________。