题目内容
【题目】(10分)已知水的电离平衡曲线如图示,试回答下列问题:
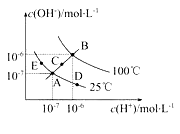
(1)图中五点Kw间的关系是_________________。
(2)若从A点到D点,可采用的措施是________________________。
a.升温 b.加入少量的盐酸 c.加入少量的NH4Cl
(3)E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_________________。
(4)B对应温度下,将pH=11的苛性钠溶液V1 L与0.05mol/L的稀硫酸V2L混合(设混合后溶液的体积等于原两溶液体积之和),所得混合溶液的pH=2,则 V1∶V2=___________________。
(5)常温下,将V mL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中充分反应。请回答下列问题(忽略溶液体积的变化)
①如果溶液pH=7,此时V的取值______________20.00(填“>”“<”或“=”)。而溶液中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为__________________________。
②如果V=40.00,则此时溶液中c(OH-)-c(H+)-c(CH3COOH)=_______mol·L-1(填数据)
【答案】(1)E=A=D<C<B
(2)bc(3)10:1(各1分)(4)9:11(2分)
(5)①<(1分)c(Na+)=c(CH3COO-)>c(H+)=c(OH-)(2分)②0.033或1/30(2分)
【解析】
试题分析:
(1)Kw只与温度有关,温度升高促进水的电离,Kw增大,因此有E=A=D<C<B;
(2)从A点到D点,溶液由中性转化为酸性,因此选项b和c均符合题意。
(3)25℃时所得混合溶液的pH=7,酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)×10-5 mol/L=V(H2SO4)×10-4mol/L,得V(NaOH)∶V(H2SO4)=10∶1。
(4)100℃时,Kw=1×10-12,此时pH=11的苛性钠溶液中c(OH-)= ![]() =0.1mol/L,0.05mol/L的稀硫酸中c(H+)=0.1mol/L,混合液的pH=2,则混合液中c(H+)=0.01mol/L,即:
=0.1mol/L,0.05mol/L的稀硫酸中c(H+)=0.1mol/L,混合液的pH=2,则混合液中c(H+)=0.01mol/L,即:![]() =0.01mol/L。解得V1:V2=9:11;
=0.01mol/L。解得V1:V2=9:11;
(5)①若加入20mL氢氧化钠溶液,两溶液恰好完全反应生成CH3COONa,因CH3COO-水解,溶液显示碱性。若要溶液pH=7,则需要氢氧化钠溶液的体积V<20.00mL。因溶液pH=7,即c(H+)=c(OH-),由电荷守恒知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(Na+)=c(CH3COO-),所以c(Na+)=c(CH3COO-)>c(H+)=c(OH-)。
②如果氢氧化钠溶液的体积V=40.00,则根据电荷守恒可得:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒可得:c(Na+)=2[c(CH3COO-)+c(CH3COOH)],两式相减可得c(OH-)-c(H+)-c(CH3COOH)=[c(CH3COO-)+c(CH3COOH)]= ![]() c(Na+)=0.033mol·L-1
c(Na+)=0.033mol·L-1

【题目】环境污染已严重已严重危害人类的生活。下列对应关系正确的是
选项 | 环境问题 | 造成环境问题的主要物质 |
A | 酸雨 | O3 |
B | 温室效应 | CO2 |
C | 南极臭氧层空洞 | SO3 |
D | 光化学烟雾 | N2 |
A. A B. B C. C D. D