题目内容
(12分)已知:N2O4(g) 2NO2(g) ΔH=+52.70 kJ·mol—1。
2NO2(g) ΔH=+52.70 kJ·mol—1。
(1)在恒温、恒容的密闭容器中进行上述反应时,下列描述中能说明该反应已达平衡的是 。
a.v(N2O4)正=2 v(NO2)逆
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(2)t℃恒温下,在固定容积为2L的密闭容器中充入0.054 mol N2O4,半分钟后达到平衡,测得容器中含n(NO2)=0.06 mol,则v(NO2) = ,t℃时反应N2O4(g) 2NO2(g)的平衡常数K=
。若向容器内继续通入少量N2O4,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后NO2的体积分数 原平衡时NO2的体积分数(填“大于”、“小于”或“等于”)。
2NO2(g)的平衡常数K=
。若向容器内继续通入少量N2O4,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后NO2的体积分数 原平衡时NO2的体积分数(填“大于”、“小于”或“等于”)。
(3)取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g) N2O4(g)。反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是 。
N2O4(g)。反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是 。

(1)bd(2)0.001 mol·L-1·s-1(或0.06 mol·L-1·min-1) 0.075 向逆反应方向 小于
(3)BD (每空2分,共12分)
【解析】(1)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A中反应速率的方向相反,但不能满足速率之比是相应的化学计量数之比,不正确;根据方程式可知,反应前后体积是变化的,所以压强和物质的量都是变化的,因此d正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,c不正确。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以b可以说明。答案选bd。
(2)n(NO2)=0.06 mol,则生成NO2的浓度是0.03mol/L,所以v(NO2) =0.03mol/L÷30s=0.001mol/(L·s);平衡时N2O4的浓度是0.054mol÷2L-0.03mol/L÷2=0.012mol/L,所以平衡常数K=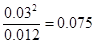 ;由于反应物和生成物都只有一种,所以再加入N2O4相当于是增大压强,平衡向逆反应方向移动,所以平衡时NO2的体积分数减小。
;由于反应物和生成物都只有一种,所以再加入N2O4相当于是增大压强,平衡向逆反应方向移动,所以平衡时NO2的体积分数减小。
(3)再没有达到平衡之前,升高温度,反应速率加快,NO2的含量逐渐减小;达到平衡后,由于正反应是放热反应,所以升高温度,平衡向逆反应方向移动,NO2的含量增大。所以A、C不正确,B、D正确,答案选BD。

已知可逆反应N2O4(g) 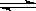 2NO2(g) 在873K时,平衡常数K1=1.78×104,转化率为a%,在1273 K时,平衡常数K2 = 2.8×104,转化率为b%,则下列叙述正确的是
2NO2(g) 在873K时,平衡常数K1=1.78×104,转化率为a%,在1273 K时,平衡常数K2 = 2.8×104,转化率为b%,则下列叙述正确的是
| A.由于K2>K1,所以a>b |
| B.由于K随温度升高而增大,所以此反应的△H>0 |
| C.由于K随温度升高而增大,所以此反应的△H<0 |
| D.其它条件不变时,将盛有该混合气体的容器置于热水中,体系颜色变浅 |
I.科学家一直致力于“人工固氮”的方法研究。目前合成氨的技术原理为氮气和氢气在高温高压催化剂条件下生成氨气,一定条件下,向一个2L的密闭容器中充入2molN2和6molH2,反应达平衡时生成NH3的浓度为0.5mol/L,并放出QkJ热量,该反应的热化学方程式可表示为______。
II.已知:N2O4(g)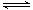 2NO2(g)
△H=+57.20kJ/mol。
2NO2(g)
△H=+57.20kJ/mol。
在1000C时,将0.100molN2O4气体充入lL恒容抽空的密闭容器中,每隔一定时间对该容器内的物质浓度进行分析得到下表数据:
|
时间(s) |
0 |
20 |
40 |
60 |
80 |
|
c(N2O4)/mol |
0.100 |
c1 |
0.050 |
c3 |
c4 |
|
c(NO2)/mol |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
(1)该反应的平衡常数表达式为______;从表中数据分析:c1 ______c2、c3______c4(选填“>”、“<”或“=”)。
(2)在右图中画出并标明此反应中N2O4和NO2的浓度随时间变化的曲线。

(3)在上述条件下,从反应开始至达到化学平衡时,四氧化二氮的平均反应速率为______。
(4)若起始时充入NO2气体0.200mol,则达到平衡时NO2 气体的转化率为______;其它条件不变时,下列措施能提高NO2转化率的是______ (填字母)。
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度
D.升高温度 E.再充入一定量的He
(5)向容积相同、温度分别为T1和T1的两个密闭容器中分别充入等量NO2,发生反应:2NO2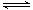 N2O4(g) (g) △H=-57.20kJ/mol。恒温恒容下反应相同时间后,分别测得体系中NO2的百分含量分别为a1和a2。巳知T1<T2,则a1____a2
(选择A、B、C、D填空)。
N2O4(g) (g) △H=-57.20kJ/mol。恒温恒容下反应相同时间后,分别测得体系中NO2的百分含量分别为a1和a2。巳知T1<T2,则a1____a2
(选择A、B、C、D填空)。
A.大于 B.小于 C.等于 D.以上都有可能
 2NO2(g) ΔH=+52.70 kJ·mol—1。
2NO2(g) ΔH=+52.70 kJ·mol—1。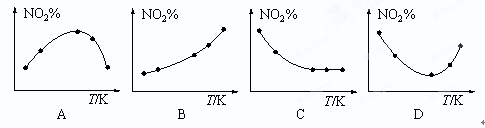
 2NO2(g) △H > 0)
2NO2(g) △H > 0)