题目内容
如图所示,用铁棒和石墨棒作电极电解1L 1mol/L食盐水,下列有关说法 正确的是 ( )
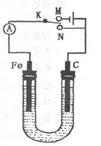

| A.电键K与N连接,铁棒被保护而免受腐蚀 |
| B.电键K与N连接,正极反应式为:4OH--4e-=2H2O +O2 ↑ |
| C.电键K与M连接,将石墨棒换成铜棒,就可实现在铁棒上镀铜 |
| D.电键K与M连接,当两极共产生标准状况下气体33.6L时,理论上生成lmol NaOH |
D
试题分析:A.电键K与N连接,构成的是原电池,Fe的活动性比C强,作负极,被氧化而受腐蚀。错误。B.电键K与N连接,构成的原电池中由于NaCl溶液是中性介质,发生的是吸氧腐蚀。正极反应式为: O2 +4e-+2H2O =4OH-。错误。C.电键K与M连接,形成的是电解池。将石墨棒换成铜棒,铜棒作阳极,被氧化为Cu2+进入溶液,在阴极Fe上,2H++2e-=H2↑..错误。D.电键K与M连接,形成的是电解池,电解食盐水。n(气体)=1.5mol.反应的方程式为:2NaCl+2H2O
 2NaOH+ H2↑+Cl2↑。n(NaCl)=1mol.所以当阳极产生n(Cl2)=0.5mol,阴极产生气体n(H2)=0.5mol时,NaCl消耗完全,这时的反应改为电解NaOH溶液,实质是电解水。2H2O
2NaOH+ H2↑+Cl2↑。n(NaCl)=1mol.所以当阳极产生n(Cl2)=0.5mol,阴极产生气体n(H2)=0.5mol时,NaCl消耗完全,这时的反应改为电解NaOH溶液,实质是电解水。2H2O 2H2↑+O2↑。NaOH的物质的量不变。根据元素守恒可得理论上生成lmol NaOH。正确。
2H2↑+O2↑。NaOH的物质的量不变。根据元素守恒可得理论上生成lmol NaOH。正确。
练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目




 2H2O
2H2O Na2Sx。回答下列问题:
Na2Sx。回答下列问题: