题目内容
2.一块表面已部分氧化(氧化层为Na2O)的金属钠样品质量为0.77g,放入100mL水中后,得到标准状况下氢气的体积224ml,求:(要求写出计算过程)(1)该样品中含金属钠多少克?
(2)所得溶液溶质的物质的量浓度约为多少?(设所得溶液的体积仍为100mL)
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算氢气的物质的量,再根据反应2Na+2H2O=2NaOH+H2↑计算样品中Na的质量;
(2)计算Na2O的质量,利用n=$\frac{m}{M}$计算二者的物质的量,再利用钠元素守恒计算生成NaOH的总物质的量,根据c=$\frac{n}{V}$计算氢氧化钠的浓度.
解答 解:(1)n(H2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,
2Na+2H2O=2NaOH+H2↑
46g 1mol
m(Na) 0.01mol
m(Na)=$\frac{46g×0.01mol}{1mol}$=0.46g,
答:金属钠样品中含金属钠质量是0.46g;
(2)m(Na2O)=0.77g-0.46g=0.31g,n(Na2O)=$\frac{0.31g}{62g/mol}$=0.005mol,混合物中n(Na)=$\frac{0.46g}{23g/mol}$=0.02mol,
根据钠元素守恒,与水反应生成的n(NaOH)=0.02mol+0.005mol×2=0.03mol,
c(NaOH)=$\frac{0.03mol}{0.1L}$=0.3mol/L,
答:所得溶液的溶质的物质的量浓度是0.3mol/L.
点评 本题考查混合物的计算、根据方程式的计算等,难度不大,注意根据Na元素质量守恒计算氢氧化钠.

练习册系列答案
相关题目
13.只用胶头滴管和试管通过两试剂的互滴,不能区别的下列溶液(浓度均为0.1mol/L)( )
| A. | NaAlO2和稀盐酸 | B. | NaHCO3和Ca(OH)2 | C. | NaOH和Al2(SO4)3 | D. | HCl和Na2CO3 |
10.苯环结构中不存在C-C单键与C=C双键的交替结构,可以作为证据的是( )
①苯不能使溴水褪色
②苯不能使酸性高锰酸钾溶液褪色
③苯在一定条件下既能发生取代反应,又能发生加成反应
④经测定,邻二甲苯只有一种结构
⑤经测定,苯环上碳碳键的键长相等.
①苯不能使溴水褪色
②苯不能使酸性高锰酸钾溶液褪色
③苯在一定条件下既能发生取代反应,又能发生加成反应
④经测定,邻二甲苯只有一种结构
⑤经测定,苯环上碳碳键的键长相等.
| A. | ①②④⑤ | B. | ①②③⑤ | C. | ①②③ | D. | ①② |
17.等质量的两份铜,分别与足量的浓硝酸和稀硝酸完全反应,在相同条件下再用排水法收集反应产生的气体,下列叙述正确的是( )
| A. | 浓硝酸消耗的HNO3少,而稀硝酸消耗的多 | |
| B. | 两者生成的Cu(NO3)2的物质的量不相同 | |
| C. | 两者用排水法收集的气体体积相同 | |
| D. | 浓硝酸产生的NO2少,而稀硝酸产生的NO多 |
7.下列叙述正确的是( )
| A. | 1 mol H2O的质量为18g•mol-1 | |
| B. | 质量数为37的氯原子 ${\;}_{37}^{17}$Cl | |
| C. | 3.01×1023个SO2分子的质量为32g | |
| D. | 标准状况下,1 mol任何物质体积均为22.4L |
14.在容量瓶上标记有的是( )
| A. | 压强 | B. | 温度 | C. | 浓度 | D. | 容量 |
11.为了检验自来水中Cl一的存在,最好选用下列试剂中的( )
| A. | 石蕊试液 | B. | 四氯化碳 | ||
| C. | 硝酸银溶液和稀盐酸 | D. | 硝酸银溶液和稀硝酸 |
12.下列说法正确的是( )
| A. | 同物质的量的N2和HCl的原子数相同,分子数也相同 | |
| B. | 0.05mol H2SO4含有氧原子数的精确值为1.024×1023 | |
| C. | 0.1mol氯的微粒数约为6.02×1023个 | |
| D. | 1mol NaClO含有阿伏加德罗常数个氯分子 |
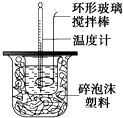 在量热器中将50ml、0.50mol•L-1CH3COOH溶液与50ml、0.55mol•L-1NaOH溶液混合,温度从25.160C升高到27.460C.已知量热计的热容常数(量热计各部件每升高10C所需的热量)是150J•0C-1,C=4.18J•g-1•0C-1,溶液的密度为1g•cm-3.
在量热器中将50ml、0.50mol•L-1CH3COOH溶液与50ml、0.55mol•L-1NaOH溶液混合,温度从25.160C升高到27.460C.已知量热计的热容常数(量热计各部件每升高10C所需的热量)是150J•0C-1,C=4.18J•g-1•0C-1,溶液的密度为1g•cm-3.