题目内容
Na2CO3·xH2O和某二价金属的氢氧化物R(OH)2的混合物36 g,溶于足量水中,二者恰好完全反应,生成白色沉淀,将沉淀滤出、洗净、烘干,其质量为10 g,高温煅烧完全反应后质量减少到5.6 g。
(1)求出R的相对原子质量;
(2)计算x的值。
(1)40 (2)10
解析:
(1)本题中涉及的化学反应:
Na2CO3·xH2O+R(OH)2====RCO3↓+2NaOH+xH2O ①
RCO3![]() RO+CO2↑ ②
RO+CO2↑ ②
可知,白色沉淀为RCO3,其质量为10 g,RO的质量为5.6 g,生成的CO2为10 g-5.6 g=4.4 g。根据碳原子守恒,得: n(Na2CO3)=n(RCO3)=n(CO2)=![]() =0.1 mol
=0.1 mol
则RCO3的摩尔质量为![]() =100 g·mol-1,即RCO3的式量为100,由此可算出R的相对原子质量为100-(12+16×3)=40。
=100 g·mol-1,即RCO3的式量为100,由此可算出R的相对原子质量为100-(12+16×3)=40。
(2)由反应式①可得出
n(Na2CO3·xH2O)=n〔R(OH)2〕=n(RCO3)=0.1 mol
则有(106+18x+74)×0.1=36,解之,x=10。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
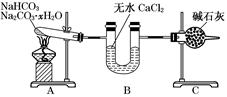
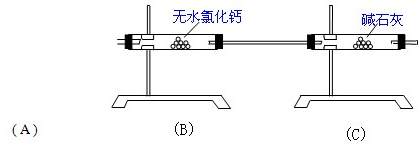 现有NaHCO3和Na2CO3?xH2O的混合物,为了测定x值,某同学设计了如下装置进行实验:
现有NaHCO3和Na2CO3?xH2O的混合物,为了测定x值,某同学设计了如下装置进行实验: