��Ŀ����
����Ŀ����1��ijͬѧ�������ʵ�鷽��̽��Ӱ��п��ϡ���ᷴӦ���ʵ����أ��й��������±���ʾ��
��� | ��п��(g) | 2.0 mol��L��1 ������Һ(mL) | �¶� (��) | ����ͭ����(g) | ��������ˮ(mL) |
�� | 2.0 | 50.0 | 25 | 0 | 0 |
�� | 2.0 | 40.0 | 25 | 0 | 10.0 |
�� | 2.0 | 50.0 | 25 | 0.2 | 0 |
�� | 2.0 | 50.0 | 25 | 4.0 | 0 |
����ʵ��������ݿ�����________________________��ʵ������ʵ��������̽��________________��п��ϡ���ᷴӦ���ʵ�Ӱ�졣
��ʵ������ʵ������Ŀ����________________��д���йط�Ӧ�����ӷ���ʽ
_______________________________________________________________��
��2��Ϊ̽����Ӧ��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬��Ƶ�ʵ�鷽�����±���

����Vx��________mL��������_________________________________��
��������1������Ӧ��������Ҫ��ʱ��(����ͬ�����²������������������Ҫ��ʱ��)��2�֣�
����Ũ����2�֣�
��̽������ͭ�����Է�Ӧ���ʵ�Ӱ����1�֣� Zn��Cu2��===Zn2����Cu��Zn��2H��===Zn2����H2����2�֣�
��2��2.0��1�֣� ��֤��Ӧ��K2S2O8Ũ�ȵĸı䣬����������Ũ�Ȳ�����2�֣�
����������1��ʵ������ʵ�����У�п��������״̬��ͬ�������Ũ�Ȳ�ͬ��ʵ������ʵ�����м�������ͭ��Cu2����������ǿ��H�������ȷ�����ӦZn��Cu2��===Zn2����Cu�����ɵ�ͭ������п���棬��ϡ������Һ�й���ԭ��أ��ӿ�пʧ���ӡ����Ǽ��������ͭ���࣬���ɵ�ͭ�Ḳ����п���棬��ֹп��ϡ�����һ����Ӧ���������������ʻ������
����ʵ��������ݿ����ǡ���Ӧ��������Ҫ��ʱ�䡱����ͬ�����²������������������Ҫ��ʱ�䡱��ʵ������ʵ��������̽�������Ũ�ȶԷ�Ӧ���ʵ�Ӱ�졣
��ʵ������ʵ�������������ͭ��������ͬ������̽����������ͭ�����뷴Ӧ���ʵĹ�ϵ��
��2��ʵ���Ŀ����̽��K2S2O8��Һ��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬��Ӧ��֤ÿ��ʵ�����������ʵ�Ũ����ȣ�����Һ����������(��Ϊ20.0 mL)���Ӷ���֪Vx��2.0 mL��

 ���㼤�������100�ִ��Ծ�ϵ�д�
���㼤�������100�ִ��Ծ�ϵ�д�����Ŀ���Լ��������ö������ױ������������������ۻ�ԭ�Ƶã�

��Ҫ��Ӧ��Ͳ�����������ʼ��±���
������ | ����״̬ | �ܽ��� | �۵㣨�棩 | �е㣨�棩 | �ܶȣ�g��cm-3�� |
�������ױ� | dz��ɫ���� | ������ˮ�������Ҵ����� | 51.4 | 237.7 | 1.286 |
�Լ����� | ��ɫƬ״���� | ����ˮ���������Ҵ����� | 43~45 | 200~202 | 1.046 |
�Լ����������� | ��ɫ���� | ������ˮ���������Ҵ����� | 243~245 | ���� | ���� |
�� | ��ɫҺ�� | ������ˮ�������Ҵ� | 5.5 | 80.1 | 0.874 |
ʵ���������£�

��ش��������⣺
��1����Ӧװ����ͼ��a��ȱ��һװ��_____________(����������)
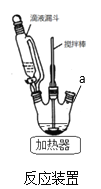
��2��������мӱ���������_____________�����������5%̼������Һ��pH=7~8��ԭ��_________
��3������۵õ��Ĺ�������Ϊ_________
��4���������������������_____________
��5���������ͨ����������������Һʹ�Լ������ᾧ������ԭ��Ϊ_____________
��6
A. ����ˮ B���Ҵ� C��NaOH��Һ D��HCl��Һ
