题目内容
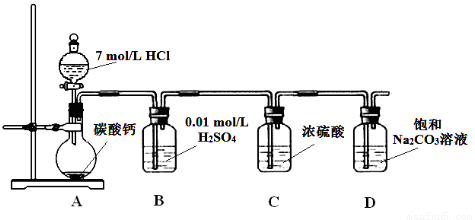
把CO2通入下列饱和溶液中,最终会有沉淀的是( )
分析:A.二氧化碳和氯化钙不反应;
B.碳酸钠与二氧化碳和水反应生成溶解度较小的NaHCO3;
C.过量的二氧化碳可以和强碱反应生成碳酸氢盐;
D.碳酸氢钠与二氧化碳不反应.
B.碳酸钠与二氧化碳和水反应生成溶解度较小的NaHCO3;
C.过量的二氧化碳可以和强碱反应生成碳酸氢盐;
D.碳酸氢钠与二氧化碳不反应.
解答:解:A.盐酸是强酸,碳酸是弱酸,所以碳酸不能制取盐酸,即二氧化碳和氯化钙不反应,最终没有沉淀析出,故A错误;
B.向饱和Na2CO3溶液中通入足量CO2发生的反应为:Na2CO3+H2O+CO2=2NaHCO3↓,碳酸氢钠的溶解性小于碳酸钠的溶解性,所以向饱和Na2CO3溶液中通入足量CO2会析出碳酸氢钠晶体,所以产生白色沉淀,故B正确;
C.向Ca(OH)2溶液中通入过量的CO2,氢氧化钙和二氧化碳先生成白色难溶性的碳酸钙Ca(OH)2+CO2=CaCO3↓+H2O,当二氧化碳过量时,碳酸钙能和二氧化碳、水放出可溶性的碳酸氢钙CaCO3+CO2+H2O=2Ca(HCO3)2,故最终一定没有白色沉淀生成,故C错误;
D.碳酸氢钠与二氧化碳不反应,最终没有沉淀析出,故最终一定没有白色沉淀生成,故D错误;
故选B.
B.向饱和Na2CO3溶液中通入足量CO2发生的反应为:Na2CO3+H2O+CO2=2NaHCO3↓,碳酸氢钠的溶解性小于碳酸钠的溶解性,所以向饱和Na2CO3溶液中通入足量CO2会析出碳酸氢钠晶体,所以产生白色沉淀,故B正确;
C.向Ca(OH)2溶液中通入过量的CO2,氢氧化钙和二氧化碳先生成白色难溶性的碳酸钙Ca(OH)2+CO2=CaCO3↓+H2O,当二氧化碳过量时,碳酸钙能和二氧化碳、水放出可溶性的碳酸氢钙CaCO3+CO2+H2O=2Ca(HCO3)2,故最终一定没有白色沉淀生成,故C错误;
D.碳酸氢钠与二氧化碳不反应,最终没有沉淀析出,故最终一定没有白色沉淀生成,故D错误;
故选B.
点评:本题考查了元素及其化合物的性质等,比较基础,熟悉复分解反应发生的条件及常见物质的溶解性是解答本题的关键,C选项为易错点注意过量条件,题目难度不大.

练习册系列答案
相关题目
把过量的CO2通入下列溶液中,最终不会产生沉淀的是( )
| A、Na2SiO3 | B、CaCl2 | C、NaAlO2 | D、饱和Na2CO3 |