题目内容
下图是部分短周期主族元素原子半径与原子序数的关系图。则下列说法正确的是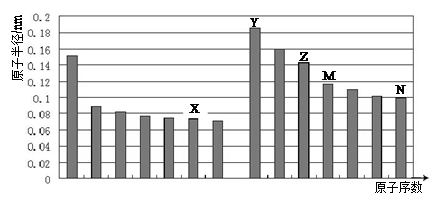
| A.Z、N两种元素的离子半径相比,前者较大 |
| B.X、N两种元素的气态氢化物的稳定性相比,前者较弱 |
| C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液 |
D
解析试题分析:图中有14种元素的原子半径,由此推断该图是第二、三周期主族元素原子半径随原子序数变化示意图,由于短周期主族元素原子半径最大的是钠,由此推断Y是Na,结合主族元素原子序数判断,X、Z、M、N分别为O、Al、Si、Cl。Z、N分别是铝、氯,铝离子具有28电子层结构,氯离子具有288电子层结构,前者的电子层数小于后者,则离子半径:Al3+<Cl-,即前者较小,故A错误;X、N分别是氧、氯,由于单质的氧化性:氧气<氯气,则气态氢化物的稳定性:H2O>HCl,故B错误;X、M分别为氧、硅,二者形成是二氧化硅是酸性氧化物,能溶于强碱,HF是唯一能溶解二氧化硅的酸,故C错误;Z、Y、N分别为铝、钠、氯,Z的氧化物为氧化铝,Al2O3是两性氧化物,Y的氢氧化物是氢氧化钠,NaOH是强碱,N的氢化物是氯化氢,HCl是强酸,Al2O3既能与NaOH反应生成NaAlO2和水,又能与HCl反应生成AlCl3和水,故D正确。
考点:考查物质结构和元素周期律,涉及主族元素简单离子半径大小比较、非金属元素气态氢化物的稳定性、二氧化硅的性质、氧化铝的性质、氢氧化钠和氯化氢的性质等。

月球上的每百吨He聚变所释放出的能量相当于目前人类一年消耗的能量,地球上氦元素主要以He的形式存在。已知一个12C原子的质量为a g,一个He原子的质量为b g,NA为阿伏加德罗常数。下列说法正确的是
| A.He比H多一个中子 | B.氦元素的近似相对原子质量为3 |
| C.He的相对原子质量为12b/a | D.He的摩尔质量为bNA |
甲、乙、丙、丁、戊为短周期原子序数依次增大的五种主族元素。乙、戊同主族,甲与乙的原子序数之和等于戊的原子序数。丙是短周期主族元素中原子半径最大的元素,丁元素在地壳中含量居金属元素的第一位。下列说法正确的是
| A.简单离子半径:丁>丙>乙>甲 |
| B.气态氢化物的稳定性:甲>乙 |
| C.甲与丙形成的化合物仅有一种 |
| D.丙、丁、戊的最高价氧化物对应的水化物之间两两均能反应 |
短周期元素X、Y、Z、W的原子序数依次增大,X的原子在元素周期表中原子半径最小,Y原子基态时最外层电子数是次外层的3倍,ZX2是一种储氢材料,W与Y属于同一主族。下列叙述正确的是
| A.原子半径:rW >rZ>rY |
| B.元素Y的简单气态氢化物的热稳定性比W的弱 |
| C.化合物从X2Y、ZY,、WY3中化学键的类型相同 |
| D.化合物ZWY4·7X2Y的水溶液显酸性 |
Q、W、X、Y、Z都是短周期元素。X、Y、Q在周期表中的位置关系如图。W、Z的最外层电子数相同,Z的核电荷数是W的2倍。则下列说法不正确的是
| IA | IIA | IIIA | IVA |
| | | | Q |
| X | | Y | |
A.非金属性:W > Z
B.原子半径:X >Y > Z
C.最高价氧化物对应水化物的碱性:X > Y
D.氢化物稳定性:Q > W
下列说法正确的是
| A. 14C与12C互为同素异形体 |
| B.高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
| C.NOx、CO2、PM2.5颗粒都会导致酸雨 |
| D.避免船体遭受腐蚀,在船舶的外壳装上若干锌块,称为外加电流的阴极保护法 |
同周期的X、Y、Z三种元素,常温下它们的气态氢化物的化学式为H2X、YH3、ZH4,下列说法正确的是( )
| A.气态氢化物的稳定性按X、Y、Z的顺序递减 |
| B.三种元素的含氧酸酸性:H4ZO4 > H3YO4> H2XO4 |
| C.元素的最高正价按X、Y、Z的顺序递减 |
| D.元素原子的半径按X、Y、Z的顺序递减 |
X、Y、Z、W是原子序数依次递增的4种短周期元素。其中X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z原子的L层电子数比K层与M层电子数之和多5个,W在同周期元素中非金属性最强。下列说法正确的是( )
| A.X、Y、Z 3种元素组成的化合物中阴、阳离子所含电子数不等 |
| B.X与Z为同主族元素,它们的单质与W单质反应均失去电子 |
| C.Y、Z、W 3种元素组成的某种化合物可用于消毒 |
| D.Y与Z的单质在常温下反应生成Z2Y2 |
