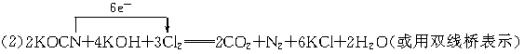题目内容
在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质.(1)某厂废水中含KCN,其浓度为650 mg·L-1.现用氯氧化法处理,发生如下反应(其中N均为-3价):
KCN+2KOH+Cl2=KOCN+2KCl+H2O
被氧化的元素是___________________.
(2)投入过量的液氯,可将氰酸盐进一步氧化为N2.请标出下列反应中电子转移的方向和数目:
2KOCN+KOH+3Cl2====CO2+N2+6KCl+H2O
(3)若处理上述废水20.0 L,使KCN完全转化为无毒物质,至少需液氯_______g.
答案:
解析:
解析:
| 解析:(1)标出反应中发生变化的元素的化合价:
可知被氧化的元素是C元素. (2)根据元素化合价的变化可标出电子转移的方向和数目.(见答案) (3)由题给两个反应得出已知量KCN与所求量Cl2的关系式:
n(KCN)= n(Cl2)= m(Cl2)=71.0 g·mol-1×0.500 mol=35.5 g 答案:(1)碳(或C)
(3)35.5
|

练习册系列答案
相关题目