题目内容
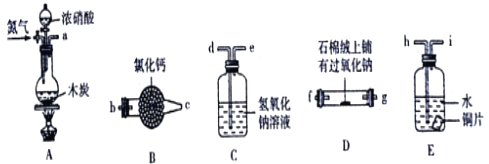
【题目】某化学课外活动小组通过实验探究NO能否与Na2O2反应以及反应后的产物,该活动小组同学设计了如图所示装置(夹持仪器、连接用的乳胶管均已省略)。
经査阅资料知:①NO是不成盐氧化物;②2NO2+2NaOH =NaNO3+NaNO2+H2O。
回答下列问题:
(1)写出木炭与浓硝酸反应的化学方程式:__________________________________。
(2)为了完成实验,同学甲选择上图中的装置,其连接顺序为a→h→i→d→e→b→c→f;但有同学乙认为该装置存在两处缺陷,则该缺陷是______________、______________。
(3)按改进后的方案连接,检验装置的气密性,装入药品后,要通入一段时间的氮气,再滴入浓硝酸,点燃酒精灯,通入氮气的主要目的是_________________________________。
(4)如果将连接顺序h→i→d→e改为d→e→h→i,会产生怎样的后果,请简述__________________________________________________________________。
(5)已知NO与Na2O2反应的产物为NaNO3和NaNO2的混合物,为了测定产物中NaNO2含量,该小组同学准确称取反应后的固体3.50g,用煮沸并冷却后的蒸馏水配成100.00mL溶液,取10.00mL溶液于锥形瓶中,用0.1000mol·L-1KMnO4溶液(硫酸酸化)滴定,共消耗KMnO4溶液20mL。滴定过程中发生反应的离子方程式为_______________________,反应产物中NaNO2的质量分数为___________(保留四位有效数字)
【答案】C +4HNO3(浓)![]() CO2↑+4NO2↑+2H2O 缺少尾气处理装置 缺少防倒吸装置 排除装置中的空气,防止NO被空气中的O2氧化为NO2 NO2被NaOH吸收,无法产生后续实验中需要的NO 2MnO4﹣+5NO2﹣+6H+=5NO3﹣ +2Mn2++3H2O 98.57%或0.99
CO2↑+4NO2↑+2H2O 缺少尾气处理装置 缺少防倒吸装置 排除装置中的空气,防止NO被空气中的O2氧化为NO2 NO2被NaOH吸收,无法产生后续实验中需要的NO 2MnO4﹣+5NO2﹣+6H+=5NO3﹣ +2Mn2++3H2O 98.57%或0.99
【解析】
(1)木炭被浓硝酸氧化成CO2,其反应方程式为C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
(2)产生NO2能与水反应,能与NaOH反应,使气体压强减小,引起倒吸,因此该装置存在的缺陷之一是缺少防倒吸装置,NO有毒,没有尾气吸收装置,本实验缺陷二:缺少尾气处理装置;
(3)实验探究NO与Na2O2的反应,装置中有空气,NO与O2反应生成NO2,通入N2的主要目的是排除装置中的空气,防止NO被氧气氧化成NO2;
(4)如果更改顺序,A装置中产生的NO2被NaOH溶液吸收,转化成NaNO3和NaNO2,无法产生后续实验中需要的NO;
(5)利用KMnO4的氧化性将NaNO2氧化成NaNO3,利用化合价升降法进行配平,离子方程式为2MnO4-+5NO2-+6H+=5NO3-+2Mn2++3H2O,NaNO2的质量分数为 ×100%=98.57%。
×100%=98.57%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案