题目内容
【题目】如图所示原电池装置,回答下列问题:
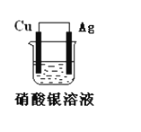
(1)此电池的负极是:______,正极的电极反应式是:________。
(2)该电池工作一段时间后,装置中出现的现象________,将银电极小心取出洗涤并晾干,经称量发现比原来增重了5.4g。则导线中通过的电子的物质的量为 ________。
【答案】铜或Cu Ag+ +e- =Ag 铜电极变细,银电极变粗,溶液颜色变蓝 0.05mol
【解析】
(1)Cu比Ag活泼,做原电池的负极,原电池中负极发生氧化反应,正极发生还原反应;
(2)根据正负极上发生的反应以及电解质溶液的浓度变化判断反应现象,根据电极反应式计算通过电子的物质的量。
(1)Cu比Ag活泼,做原电池的负极,Ag为原电池的正极,发生还原反应,电极反应为Ag++e-=Ag,
故答案为:铜或Cu,Ag++e-=Ag。
(2)原电池工作时,负极铜失去电子被氧化生成铜离子,铜的质量逐渐减少,银极上生成银,质量逐渐增大,溶液中生成铜离子,溶液颜色变蓝,当银电极质量增加5.4g,则n(Ag)=![]() =0.05mol,根据电极反应Ag++e-=Ag,可知导线中通过的电子的物质的量为0.05mol。
=0.05mol,根据电极反应Ag++e-=Ag,可知导线中通过的电子的物质的量为0.05mol。
故答案为:铜电极变细,银电极变粗,溶液颜色变蓝;0.05mol。

练习册系列答案
相关题目